Peroxiden -eigenschappen, nomenclatuur, gebruik, voorbeelden
- 1834
- 347
- Dr. Rickey Hudson
De peroxiden Het zijn al die chemische verbindingen die de peroxo-groep, O-O bevatten, ofwel covalent gekoppeld aan koolstofatomen of andere functionele groepen, of in ionische vorm zoals het peroxide-anion, of22-. Het bovenstaande is grafisch weergegeven in de onderstaande afbeelding. Daarin valt de O-O-groep op met een blauwe kleur.
Er kunnen organische peroxiden zijn zoals diaquilperoxiden (r1-O-o-r2), Hydroperoxiden (r-o-o-h), peracides (rco-o-o-h) en peéstres (r1Co-o-o-r2)). We hebben ook anorganische peroxiden, zoals metaalperoxiden (mN+OF22-) en waterstofperoxide (H-O-H). De laatste is de bekendste van allemaal, die de naam van waterstofperoxide ontvangt.
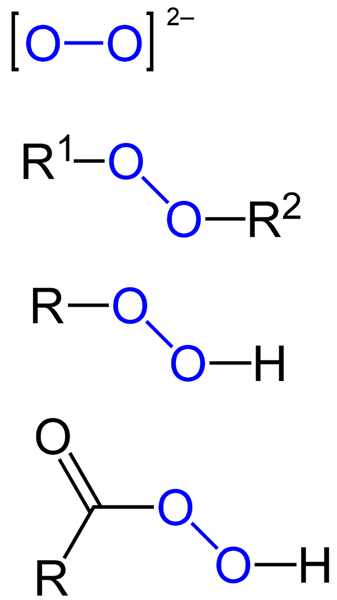 Formules voor verschillende soorten peroxiden die bestaan. Bron: Jü / Public Domain
Formules voor verschillende soorten peroxiden die bestaan. Bron: Jü / Public Domain Alle peroxiden delen gemeenschappelijk de eigenschap van zeer reactieve, oxiderende stoffen en, in sommige gevallen, explosief. Tenzij ze niet worden gespecificeerd door ze te synthetiseren, worden ze beschouwd als ongewenste en gevaarlijke onzuiverheden voor veel industriële processen en voor laboratoriumsynthese.
Peroxiden in het algemeen zijn uitstekende oxidatiemiddelen, bleken, bactericiden en polymerisatiesactivatoren via vrije radicalenvorming. Daarom zijn het meestal zeer nuttige reagentia of additieven in de polymeerindustrie, evenals in de voedingsindustrie om oxidaties te versnellen en bacteriën te elimineren.
[TOC]
Peroxide -eigenschappen
Structuur
Peroxidestructuren focussen rond de O-O-groep. Elk zuurstofatoom heeft een SP -hybridisatie3, Dus de links -o -Do rust niet in hetzelfde vlak. Voor waterstofperoxide, H-O-H, is de hoek gevormd tussen de twee H bijvoorbeeld 115.5e, waaruit blijkt dat de vier atomen niet in een vliegtuig staan.
De vervormingen hiervan en andere hoeken zullen afhangen van de identiteit van de andere moleculaire fragmenten die zijn gekoppeld aan de O-O-groep.
Het kan u van dienst zijn: Gibbs Free Energy: eenheden, hoe het wordt berekend, opgeloste oefeningenAan de andere kant kunnen organische en anorganische peroxiden (behalve metallic) met het blote oog worden herkend als de O-O-groep gedetailleerd is in hun structuur, zoals twee glazen met een "mond". Op deze manier wordt peroxide onmiddellijk geïdentificeerd met een enkele weergave van de structuur.
Reactiviteit
De O-O-link is relatief zwak in vergelijking met andere links zoals C-H of C-O. Daarom heeft het de neiging om te breken of te fragmenteren om zeer reactieve geoxygeneerde radicalen te produceren.
Ze zijn vanwege deze radicalen dat peroxiden worden geclassificeerd als reactieve en gevaarlijke stoffen, omdat ze weefsels en alle organische stof in het algemeen kunnen beschadigen.
Oxiderende actie
Peroxiden zijn krachtige oxidatiemiddelen, die elektronen uit de omgeving willen krijgen om te transformeren in water, zuurstof of hydroxiden. Waterstofperoxide is bijvoorbeeld een sterker oxidatiemiddel dan hetzelfde kaliumpermanganaat.
Deze oxiderende werking wordt gebruikt om ze door hun reactie te detecteren met ijzersulfaat en kaliumtiocyanaat:
Peroxide +geloof2+ + SCN- → Fe (SCN)N(3-N)- (N = 1 tot 6).
Het complex gevormd tussen geloof3+ en de SCN- Het is bloedrood, dus de observatie van deze kleur komt overeen met een positieve test voor de aanwezigheid van peroxiden in het monster.
Gevoeligheid
Peroxiden zijn stoffen die gevoelig zijn voor hoge temperaturen en zonlicht. Daarom moeten ze worden opgeslagen op veilige locaties en binnen plastic en ondoorzichtige containers, zodat licht hen niet direct beïnvloedt.
Nomenclatuur
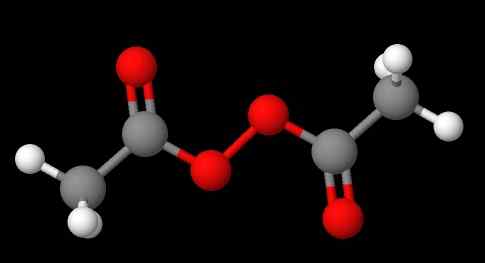
De nomenclatuur van peroxiden hangt af van welk type ze behoren. Over het algemeen worden velen benoemd door 'peroxide van' te vermelden. Bijvoorbeeld samengestelde ch3C (O) OOC (O) CH3 (onderste afbeelding) wordt diacetyl- of acetylperoxide genoemd, omdat deze aan elk uiteinde een acetylgroep heeft.
Kan u dienen: natriumsulfaat (Na2SO4): structuur, eigenschappen, gebruik, verkrijgen Diacetylperoxide. Bron: Gabriel Bolívar via Molview.
Diacetylperoxide. Bron: Gabriel Bolívar via Molview. De verbinding c6H5C (O) OOC (O) C6H5 (lagere afbeelding) Aan de andere kant wordt het dibenzoílo of benzoílo peroxide genoemd, om dezelfde redenen in de vorige paragraaf.
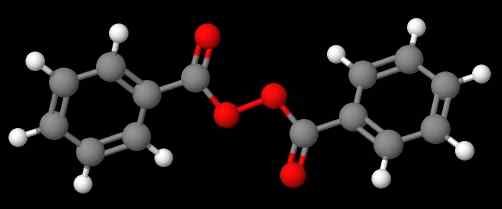 Benzoylperoxide. Bron: Gabriel Bolívar via Molview.
Benzoylperoxide. Bron: Gabriel Bolívar via Molview. Ondertussen, verbinding c6H5C (O) OOC (O) CH3 wordt acetylbenzolelo peroxide genoemd. Deze keer wordt de acetylsubstituent eerst genoemd om te beginnen met de letter 'a'. Een ander voorbeeld is ch3Ch2OOC6H5, Ethylfenylperoxide genoemd.
Ga op dezelfde manier verder met hydroperoxiden. Bijvoorbeeld cho3Ooh wordt methylhydroperoxide genoemd.
Opleiding
Sommige peroxiden kunnen direct worden gevormd door de blootstelling van de substantie in kwestie met de zuurstof van de lucht, geholpen of niet met metalen katalysatoren. Ze kunnen zich ook vormen door de stof bloot te stellen aan ozon onder bepaalde omstandigheden, waardoor de ozonolysereactie wordt uitgevoerd.
Een andere synthetische route is om waterstofperoxide te reageren met een alkylorsulfaat:
R2SW4 + H2OF2 → R-O-R +H2SW4
Om diachilische peroxiden of zelfs cyclische peroxiden te synthetiseren of te vormen.
Ondertussen zijn verschillende van de methoden om metaalperoxiden te vormen gebaseerd op het oxygenen van hun respectieve metaaloxiden, zodat ze "zuurstof" zijn en van mo gaan (mN+OF2-) Liefde2 (MN+OF22-)).
Peroxides gebruikt
Polymerisaties initiatiefnemers
Peroxiden, vooral organische peroxiden, worden toegevoegd aan de reactiemiddelen voor de synthese van infiniteiten van kunststoffen en materialen zoals polystyreen, siliconen, epoxy en acrylharsen, polyvinylchloride, glasvezel, tussen anderen.
Dit komt omdat ze thermische ontledingen lijden om geoxygeneerde vrije radicalen te worden, die op hun beurt polymerisaties veroorzaken en katalyseren. Daarom zijn ze wenselijk in de polymeerindustrie.
Het kan u van dienst zijn: Molaire fractie: hoe het wordt berekend, voorbeelden, oefeningenSommige van de peroxiden die als initiatiefnemers worden gebruikt, zijn methylcetona (MEK) peroxide en acetonperoxide.
Bleekmiddel en desinfectiemiddelen
Peroxiden zijn bleekmiddelen, gebruikt voor het bleken van papier en bloempulp. Ze zijn ook desinfectiemiddelen, volledig effectief maar agressief in termen van uitroeiing van bacteriën. Het klassieke voorbeeld komt overeen met waterstofperoxide, bedoeld in verdunde oplossingen (3%) om wonden te desinfecteren.
Oxiderende middelen
Peroxiden zijn ook oxidatiemiddelen, dus ze vinden veel toepassingen in de organische synthese van zeer geoxygeneerde stoffen.
Zuurstofbronnen
Hoewel het niet tot het belangrijkste gebruik is, kunnen peroxiden ook in sommige van hun storingen als bronnen van zuurstof dienen. Dit is opnieuw het geval van het waterstofperoxide.
Voorbeelden van peroxiden
Ten slotte zullen enkele voorbeelden van peroxiden worden vermeld, organisch of anorganisch, met hun formules en respectieve namen:
-H2OF2: Waterstof of waterstofperoxide
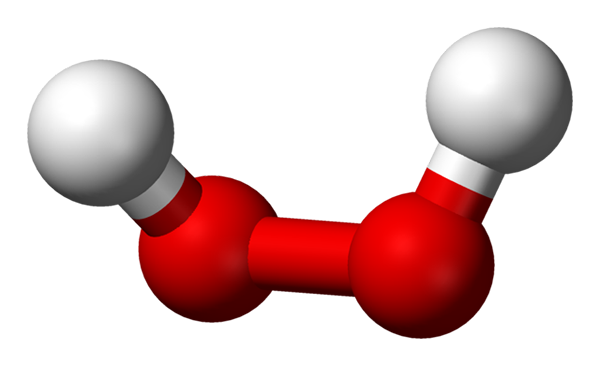 Waterstofperoxidemolecuul vertegenwoordigd met een bollen en stavenmodel. Bron: Benjah-bmm27 via Wikipedia.
Waterstofperoxidemolecuul vertegenwoordigd met een bollen en stavenmodel. Bron: Benjah-bmm27 via Wikipedia. -NA2OF2: Natriumperoxide
-Straal2: Bariumperoxide
-C6H5C (Ch3))2OOH: Cummeno Hydroperoxide
-(NH4))2S2OF8: Ammoniumpersulfaat
- In3Sooso3H: peroxidisulfuriczuur
-(Ch3))3COOC (Ch3))3: Ditert-butylperoxide
Referenties
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e Editie.)). Wiley Plus.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2020). Organisch peroxide. Opgehaald uit: in.Wikipedia.borg
- Elsevier B.V. (2020). Peroxide. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- Geavanceerde chemieontwikkeling. (S.F.)). Alcoholen, fenolen en hun afgeleid:
- Peroxidenregel C-218. Hersteld van: acdlabs.com
- Vol'nov i.Je., Petrocelli a.W. (1966) Classificatie en nomenclatuur van anorganische peroxideverbindingen. In: Petrocelli a.W. (Eds) Peroxiden, superoxiden en ozoniden van alkali en alkalische aardmetalen. Springer, Boston, MA.
- « Typische Baja California Sur voor mannen en vrouwen (beschrijving)
- Haloid verkoopeigenschappen, nomenclatuur, hoe worden ze gevormd, voorbeelden »

