Diazoniumzouten

- 1417
- 145
- Alton D'Amore
We leggen uit wat diazoniumzouten zijn, hoe hun eigenschappen en toepassingen worden gevormd
Wat zijn diazoniumzouten?
De Diazoniumzouten Het zijn organische verbindingen waarin er ionische interacties zijn tussen de AZO-groep (-n2+) En een anion x- (Cl-, F-, Ch3Coo-, enz.)). De algemene chemische formule is RN2+X-, en hierin kan de zijketen R goed een alifatische groep of een arylgroep zijn; dat wil zeggen een aromatische ring.
In het lagere beeld wordt de structuur van het arenodiazoniumion weergegeven. De blauwe bollen komen overeen met de AZO -groep, terwijl zwart en wit de aromatische ring van de fenylgroep vormen. De az+≡N).

Er zijn echter resonantiestructuren die deze positieve belasting delocaliseren, bijvoorbeeld in het atoom van naburige stikstof: -n = n+. Dit is afkomstig wanneer een paar elektronen die een link vormt, naar het stikstofatoom aan de linkerkant wordt gericht.
Evenzo kan deze positieve belasting door het PI -systeem van de aromatische ring demociëren. Als gevolg hiervan zijn aromatische diazoniumzouten stabieler dan alifatisch, omdat de positieve belasting niet langs een koolstofketen kan democeren (CH3, Ch2Ch3, enz.)).
Opleiding
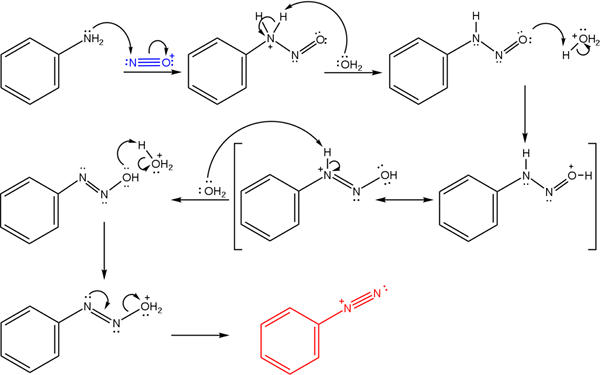
Deze zouten komen voort uit de reactie van een primair amina met een zuurmengsel van natriumnitriet (nano2)).
Secundaire amines (r2NH) en Tertiaary (r3N) Andere stikstofproducten zoals n-nitrosoamine (die geelachtige oliën zijn), amine zouten (r3HN+X-) en nitrosoniumverbindingen.
Het superieure beeld illustreert het mechanisme waardoor de vorming van diazoniumzouten, of ook bekend als diazotisatiereactie wordt bepaald.
Kan u van dienst zijn: Chrome (CR)De reactie begint bij fenylamine (AR-NH2), die een nucleofiele aanval uitvoert op het nitrosoniumkationatoom (nee+)). Dit kation wordt geproduceerd door het nano -mengsel2/HX, waarbij X meestal Cl is; dat wil zeggen HCl.
De vorming van het nitrosoniumkation brengt water in het midden vrij, dat een positief geladen stikstofproton weggaat.
Vervolgens verschilt dit zelfde watermolecuul (of andere zure soorten van h3OF+) Geef een proton op aan zuurstof, democreert de positieve belasting in het minder elektronegatieve stikstofatoom).
Nu, het water opnieuw onbeschermd tot stikstof en vervolgens het diazohydroxidemolecuul produceert (de antepenultimaat van de sequentie).
Omdat het medium zuur is, lijdt het diazohydroxide uitdroging van de OH -groep; Om de elektronische vacature tegen te gaan, het gratis koppel van de drievoudige schakel van de AZO -groep.
Op deze manier blijft het Bencenodiazonium -chloride aan het einde van het mechanisme in oplossing (C6H5N2+Klet-)).
Eigenschappen
Over het algemeen zijn diazoniumzouten kleurloos en kristallijn, oplosbaar en stabiel bij lage temperaturen (minder dan 5 ° C).
Sommige van deze zouten zijn zo gevoelig voor mechanische impact, dat elke fysieke manipulatie hen kan ontploffen. Ten slotte reageren ze met water om fenolen te vormen.
Verplaatsingsreacties
Diazoniumzouten zijn potentiële moleculaire stikstof, waarvan de vorming de gemeenschappelijke noemer is van verplaatsingsreacties. Hierin verplaatst een soort x de onstabiele azo -groep, ontsnapt als n2(G).
Sandmeyer -reactie
RNA2+ + Cucl => arcl + n2 + Cu+
RNA2+ + Cucn => arcn + n2 + Cu+
Gatterman -reactie
RNA2+ + Cux => arx + n2 + Cu+
In tegenstelling tot de reactie van Sandmeyer heeft de reactie van Gatterman metalen koper in plaats van zijn halide; dat wil zeggen, de CUX wordt gegenereerd In situ.
Schiemann -reactie
[RNA2+] BF4- => Arf + BF3 + N2
Kan u van dienst zijn: ketonen: typen, eigenschappen, nomenclatuur, gebruik, voorbeeldenDe reactie van Schiemann wordt gekenmerkt door de thermische ontleding van benzezonium fluoroboraat.
Gomberg Bachmann reactie
[RNA2+] Cl- + C6H6 => AR - C6H5 + N2 + HCl
Andere verplaatsingen
RNA2+ + Ki => Ari + K+ + N2
[RNA2+] Cl- + H3Po2 + H2O => c6H6 + N2 + H3Po3 + HCl
RNA2+ + H2O => aroh + n2 + H+
RNA2+ + Stempel2 => Arno2 + N2 + Cu+
Redox -reacties
Diazoniumzouten kunnen worden gereduceerd tot arilhydrazines, met behulp van een mengsel van CNCL2/HCl:
RNA2+ => Arnhnh2
Ze kunnen ook worden gereduceerd tot arilamines in sterkere reducties met Zn/HCl:
RNA2+ => Rnah2 + NH4Klet
Fotochemische ontleding
[RNA2+] X- => Arx + n2
Diazoniumzouten zijn gevoelig voor het ontbinden door de incidentie van ultraviolette straling, of op zeer nauwe golflengten.
Azo -koppelingsreacties
RNA2+ + Ar'h → RNA2Ar ' + h+
Deze reacties zijn misschien wel de meest bruikbare en veelzijdige diazoniumzouten. Deze zouten zijn zwakke elektrofielen (de ring verplaatst de positieve belasting van de AZO -groep). Om te reageren met aromatische verbindingen, moeten ze negatief worden geladen, waardoor Azos -verbindingen worden veroorzaakt.
De reactie gaat door met een efficiënte prestaties tussen een pH van 5 en 7. In zure pH is de koppeling lager omdat de AZO -groep protonen, waardoor de aanval van de negatieve ring onmogelijk is.
Ook reageert in basis pH (groter dan 10) diazoniumzout met OH- Om diazohydroxide te produceren, dat relatief inert is.
Structuren van dit type organische verbindingen hebben een zeer stabiel geconjugeerd PI -systeem, waarvan de elektronen straling absorberen en uitzenden in het zichtbare spectrum.
Bijgevolg worden AZO -verbindingen gekenmerkt door kleurrijk te zijn. Vanwege deze eigenschap zijn ze ook azoïsche kleuren genoemd.
Kan u dienen: Molariteit: concentratie, eenheden, berekening, oefeningen
Het superieure beeld illustreert het concept van de koppeling met de sinaasappel van methyl als een voorbeeld. In het midden van zijn structuur kan de AZO -groep worden waargenomen als de connector van de twee aromatische ringen.
Welke van de twee ringen was de elektrofie aan het begin van de koppeling? Degene aan de rechterkant, omdat de sulfonaatgroep (-so3) Verwijder de elektronische ringdichtheid, waardoor het nog meer elektrofiel is.
Toepassingen

Een van de meest commerciële toepassingen is de productie van kleurstoffen en pigmenten, die ook de textielindustrie dekken in stoffen treden. Deze azoïsche verbindingen zijn verankerd aan specifieke moleculaire plaatsen van het polymeer, stervend aan kleuren.
Vanwege de fotolitische ontleding wordt het (minder dan voorheen) gebruikt bij de reproductie van documenten. Als? De papieren gebieden die door een speciaal plastic worden bedekt, worden verwijderd en vervolgens worden een basisfenoloplossing aangebracht, die de letters of design blauw kleurt.
In de organische synthese worden ze gebruikt als uitgangspunten voor veel aromatische derivaten.
Ten slotte hebben ze toepassingen op het gebied van slimme materialen. Hierin zijn een oppervlak (bijvoorbeeld goud) gekoppeld, waardoor het een chemische reactie kan geven op externe fysische stimuli.

