Markovnikov -regel
- 3934
- 1127
- Glen Armstrong
Wat is de regel van Markovnikov?
De Markovnikov -regel Het is een empirische regel, geformuleerd in 1869 door de Russische chemicus Vladimir Markovnikov, die wordt gebruikt om de regioselectiviteit van de producten van een elektrofiele toevoeging te voorspellen. Zelfs vandaag is het nog steeds van kracht en onthult het zijn eenvoud in hoe het mechanisme van verschillende organische reacties komt.
Deze regel is vooral van toepassing op alkenen in hun hydrohalogenatiereacties. Het maakt dus mogelijk om te voorspellen wat de meerderheidsproducten zullen zijn wanneer alkenen en alkynes reageren met HX (HF, HCl, HBR en HI).
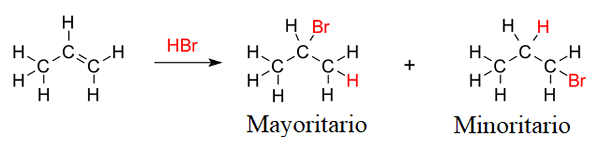 Waardering van de Markovnikov -regel in de hydrohalogenering van de propeno. Bron: V8rik, CC BY-SA 3.0, via Wikimedia Commons
Waardering van de Markovnikov -regel in de hydrohalogenering van de propeno. Bron: V8rik, CC BY-SA 3.0, via Wikimedia Commons Stel bijvoorbeeld dat de hydrobromatie van het propeno of propyleen (superieure afbeelding). De regel van Markovnikov voorspelt dat het meerderheidsproduct degene zal zijn waarin het broomatoom is gekoppeld aan de koolstof van het centrum; Terwijl in het kleine product, eindigt de broom tot de dubbele bindingskoolstof.
Merk op dat het meerderheidsproduct het waterstofatoom heeft gekoppeld aan terminale koolstof. Dit laatste punt is het gemakkelijkst te onthouden: de HX-waterstof gaat naar de koolstof van de dubbele binding die meer waterstof- of C-H-bindingen heeft.
Principes van de Markovnikov -regel
Elektrofiele toevoeging
Aan de dubbele bindingen van alkenen of alkines. De HX heeft een slecht elektronenatoom, dat is H, en een atoom rijk aan elektronen, dat is x.
Daarom kan HX worden weergegeven als hδ+-Xδ-, De regio zijn hδ+ Gevoelig voor het ontvangen van elektronen van, in dit geval, dubbele binding van een alkeen, die de elektrofylische aanval plaatsvindt (zie afbeelding hieronder).
Kan u bedienen: fenylacezuur: structuur, eigenschappen, gebruik, effectenCarbocatiestabiliteit
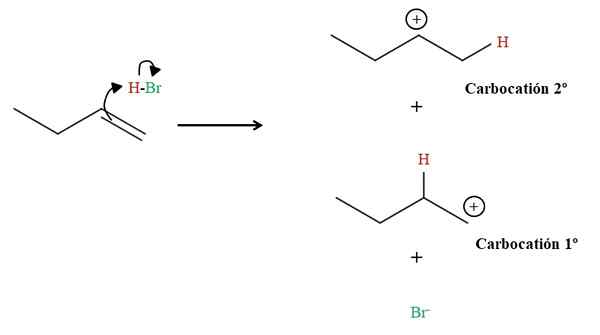
 Vorming van de twee carbocaties in de hidrobromatie van 1-buteen. Bron: Gabriel Bolívar via Molview.
Vorming van de twee carbocaties in de hidrobromatie van 1-buteen. Bron: Gabriel Bolívar via Molview. Zoals hierboven te zien is, valt de 1-Buteen dubbele binding de HBO-waterstof aan. Daarbij "open" de elektronen van de H-BR-binding naar het broomatoom, die een carbocatie vormen en het anion br-. Er is echter de mogelijkheid om twee carbocaties te vormen: de ene primaire (1e) en de andere secundaire (2e).
Elke carbocatie is een intermediaire verbinding waaruit het eindproduct zal afleiden. Als er twee carbocaties zijn, hebben we dan twee producten: 2-Broomobutano en 1-Broomobutano. De br- Het fungeert als een nucleofiel die een van de twee carbocaties aanvalt:
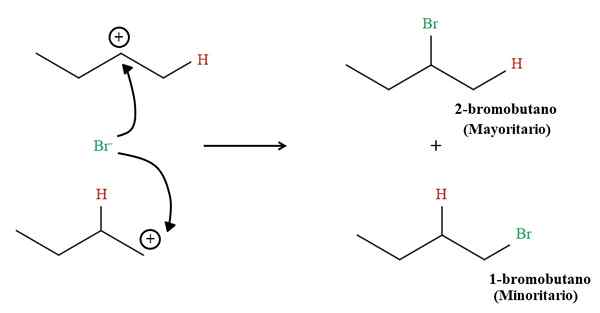 1-Buteen hydrobromatieproducten. Bron: Gabriel Bolívar via Molview.
1-Buteen hydrobromatieproducten. Bron: Gabriel Bolívar via Molview. Maar het aandeel van beide producten is niet 50%; De 2-broomobutano komt veel groter voor dan het 1-broomobutaan.
De reden is dat de 2e carbocatie stabieler is dan 1e carbocatie, omdat de positieve belasting beter wordt gestabiliseerd door aangrenzende koolstofatomen; Terwijl in carbocatie 1, draagt het waterstofatoom niet bijna elke elektronische dichtheid bij aan die positieve belasting (voor inductie of hyperconjugatie).
De rijken worden rijker
De heerschappij van Markovnikov werd geboren uit de laatste observaties, en van hen konden de hierboven geïllustreerde mechanismen worden overwogen om ze uit te leggen.
Zonder de noodzaak om deze mechanismen altijd vast te leggen, of de stabiliteit van intermediaire carbocaties af te trekken, wordt de eenvoudige regel gebruikt: bij een elektrofiele toevoeging worden waterstofatomen naar de dubbele koolstof gericht met de dubbele met meer waterstofatomen. Aldus wordt de meest gehydrogeneerde koolstof nog meer gehydrogeneerd.
Kan u van dienst zijn: wat zijn waterafwijkingen?Aan de andere kant eindigt de atoom X, in dit geval de BR, in de koolstof van de dubbele binding die meer C-C-bindingen heeft, of die meer wordt vervangen door andere atomen die geen waterstof zijn. Omdat in het 1-buteen zijn terminale koolstof is = cho2, Dit is degene die waterstof ontvangt om te transformeren in de -ch -groep3.
Voorbeelden
Het geval van de Markovnikov -regel toegepast in de hydrobromatiereactie werd hierboven gezien. Het is ook geldig voor hydrocloclinatie, hydroiodatie, hydroaminatie- en hydratatiereacties, hetzij voor alkenen of alkines.
In de volgende sectie zullen enkele aanvullende voorbeelden worden gezien als een oefeningen.
Opgeloste oefeningen
Oefening 1
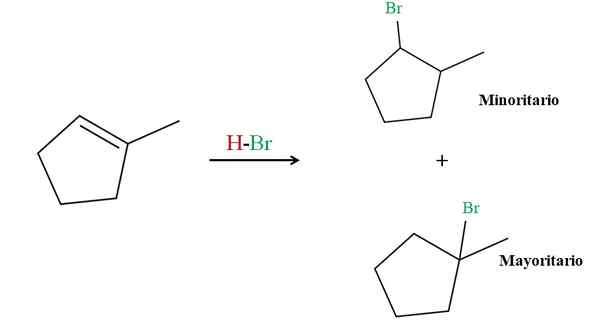 Hydrobromatie van het 2-methylciclopene. Bron: Gabriel Bolívar via Molview.
Hydrobromatie van het 2-methylciclopene. Bron: Gabriel Bolívar via Molview. De regel van Markovnikov zegt dat de HBR H voor de bovenste reactie naar de dubbele bindingskoolstof moet gaan met meer waterstofatomen. In dit geval komt het overeen met de koolstof hierboven, omdat de koolstof aan de rechterkant is gekoppeld aan Cho3, Het heeft zelfs geen waterstofatomen.
Aldus gaat de HBR -waterstof naar de koolstof hierboven, terwijl de BR aan de rechterkant wordt gekoppeld aan koolstof (meerderheidsproduct). Aan de andere kant, als waterstof is gekoppeld aan de koolstof aan de rechterkant, wordt de BR gericht op de koolstof hierboven (minder product).
Merk op dat het meerderheidsproduct bestaat uit een 3e halogenide, per definitie stabieler en stabilisatie -effecten van gedeeltelijke positieve belastingen; Terwijl het minderheidsproduct een 2e, minder stabiel halide is.
Zowel producten, de meerderheid als de mindere. Dit type minderheidsproduct, tegen de Markovnikov -regel, staat bekend als Antimarkovnikov -product.
Kan u bedienen: referentie -elektrode: kenmerken, functie, voorbeeldenOefening 2
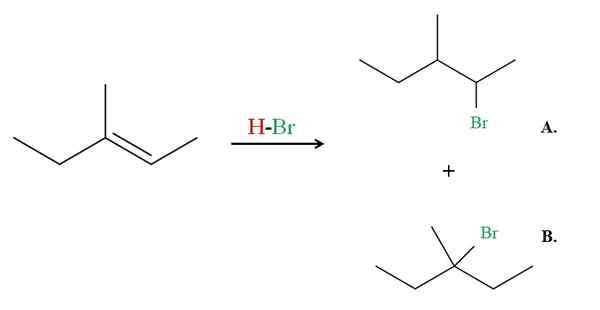 Hydrobromatie van 3-methyl-2-penteen. Bron: Gabriel Bolívar via Molview.
Hydrobromatie van 3-methyl-2-penteen. Bron: Gabriel Bolívar via Molview. Zie nu het voorbeeld van 3-methyl-2-penteen.
Indien waargenomen, heeft de rechter koolstof van de dubbele binding een H, terwijl die aan de linkerkant. Daarom zal de H van de HBR naar die koolstof gaan, de koolstof moet naar het centrum gaan om product B te veroorzaken. Product B is de meerderheid, want het is opnieuw een 3e halide, waarbij het product een haluro 2e is.
Oefening 3
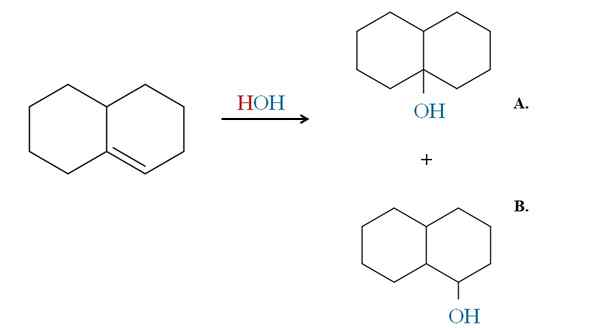 Voorbeeld van de Markovnikov -regel bij de hydratatie van een cyclische alkeen. Bron: Gabriel Bolívar via Molview.
Voorbeeld van de Markovnikov -regel bij de hydratatie van een cyclische alkeen. Bron: Gabriel Bolívar via Molview. De vorige voorbeelden zouden dezelfde producten hebben gegenereerd als in plaats van HBR HCL en HI zou worden gebruikt. Hetzelfde is hetzelfde als met h2O In een hydratatiereactie gekatalyseerd door zuur en warmte. Oh komt om het HX -atoom te vervangen.
Daarom vertelt de regel van Markovnikov ons dat OH in de elektrofiele toevoeging hierboven naar de koolstof van de meest vervangen dubbele binding gaat, met minder waterstof.
Product A is dus de meerderheid en product B de minderheid. Merk op dat product A een 3e alcohol is en product B A 2e alcohol.
Referenties
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5e editie. Redactionele addison-wesley inter-Amerikaan.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e editie.)). Wiley Plus.
- Wikipedia. (2020). Rule van Markovnikov. Opgehaald uit: in.Wikipedia.borg
- Steven A. Hardinger. (2017). Geïllustreerde woordenlijst van organische chemie: de regel van Markovnikov. Hersteld van: chem.UCLA.Edu
- Gamini Gunawardena. (24 augustus 2020). Rule van Markovnikov. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- De redacteuren van Enyclopaedia Britannica. (17 september 2013). Rule van Markovnikov. Hersteld van: Britannica.com
- Dr. S. Hevorg. (2020). Organische chemie: de regel van Markovnikov met praktijkproblemen. Hersteld van: chemistroysteps.com

