Verbranding warmte

- 5099
- 1449
- Aaron Okuneva
Wat is de warmte van verbranding?
Hij Verbranding warmte Het is de energie die vrijkomt wanneer een bepaalde hoeveelheid materiaal, meestal één mol, exotermisch reageert met de zuurstof van de lucht. Het is een essentiële eigenschap thermochemie bij de karakterisering van brandstoffen, alcoholen en vooral koolwaterstoffen, zoals butaan en methaan.
Wanneer een stof licht en warmte verbrandt, energie die kan worden gebruikt om op andere lichamen te werken. De gegenereerde warmte is bijvoorbeeld in staat om grote hoeveelheden water te verwarmen, waarvan de stoom de omgeving drukt, wat sommige elektrische generatoren handelt; of gewoon, verder verwarmende gestoomde voedingsmiddelen.
 De warmte die wordt gegenereerd door de verbranding van het keukengas wordt gebruikt om de ketels en voedsel te verwarmen
De warmte die wordt gegenereerd door de verbranding van het keukengas wordt gebruikt om de ketels en voedsel te verwarmen Verbrandingswarmte varieert tussen alle stoffen, hoewel de chemische aard ervan in wezen hetzelfde is. Deze variatie komt overeen met relatieve stabiliteit, dat wil zeggen: hoe onstabieler een verbinding, hoe groter de vrijgegeven energie, weergegeven als -Ah. Het negatieve symbool betekent dat warmte eruit stroomt.
Verschillende -AH -waarden worden gebruikt om de relatieve stabiliteit tussen verschillende alkause en hun isomeren te vergelijken. Het laat het ook stabiel zijn.
Meting
Om verbrandingsverwarming te meten, is een calorimetrische pomp nodig. Daarin reageert de stof met zuurstof door de activering van een elektrische vonk.
Vervolgens verwarmt de vrijgegeven warmte een volume water dat het monstercompartiment omringt, de temperatuur meten voor en na verbranding, evenals de massa water en brandstof.
Dus de vrijgegeven energie zal gelijk zijn aan:
Ceh2o·MH2Of · Δt
Waareh2o Het is de specifieke waterwarmte, 4.184 J/G · ºC, MH2Of de massa van het water, en Δt zijn temperatuurverandering. Ten slotte is deze warmte, uitgedrukt in Joule of calorie -eenheden, verdeeld tussen de massa of de mol van de brandstof die in de calorimetrische pomp is geplaatst, om de verbrandwarmte per massa -eenheid of moeder te verkrijgen.
Kan u van dienst zijn: wat is het mechanische equivalent van warmte?Metalen combineren zichzelf niet, maar oxideren bij verschillende snelheden, afhankelijk van de temperatuur waaraan ze worden blootgesteld. De warmte die ze produceren is verachtelijk om op dezelfde manier te worden gemeten als met koolwaterstoffen en andere brandstoffen. Het zijn daarom geen brandbare stoffen.
Potentiële energieën
Tijdens de verbranding worden de links verbroken om nieuwe te vormen, stabieler. De energie in alle molecuulverbindingen is onafhankelijk van zijn beweging, dus er is een potentiële energie.
Hoe groter de potentiële energie, hoe onstabieler het molecuul zal zijn en daarom zal het meer warmte vrijgeven zodra de nieuwe links zijn gevestigd.
Om te weten welke precies deze nieuwe links zijn, moeten de producten van een volledige verbranding worden overwogen: CO2 Voor koolstof, h2Of voor waterstof, en niet2 Voor stikstof. Met betrekking tot koolwaterstoffen zal hun volledige verbranding stoichiometrische mengsels van CO genereren2 en h2OF.
Beide moleculen, CO2 en h2Of ze hebben een zeer lage potentiële energieën, omdat hun links (O = C = O en H-O-H) zeer stabiel zijn in vergelijking met de koolwaterstofverbindingen waaruit ze kwamen (C-H en C-C).
Relatieve stabiliteit
Potentiële energieën zijn vrijelijk. Maar hun variaties zijn niet, dat wil zeggen het verschil van die energieën tussen de producten (CO2 en h2O) en reactanten (koolwaterstoffen).
Dat is de reden waarom met deze variaties, of wat hetzelfde is, hun verbranding verwarmt, u kunt weten wat de relatieve stabiliteit is tussen een set koolwaterstoffen of isomeren.
Sluiten
De alkanen kunnen lineair, vertakt of cyclisch zijn. In het geval van lineaire alkanen varieert de verbrandingswarmte afhankelijk van de lengte van zijn ketens; dat wil zeggen, het hangt af van hoeveel eenheden ch2 hebben. Overweeg het voorbeeld van N-hexaan, N-heptano en N-octaan:
Het kan u van dienst zijn: jodium: geschiedenis, eigenschappen, structuur, verkrijgen, risico's, gebruikCh3(Ch2))4Ch3, -ΔH = 4163 kJ/mol
Ch3(Ch2))5Ch3, -ΔH = 4817 kJ/mol
Ch3(Ch2))6Ch3, -ΔH = 5471 kJ/mol
Je kunt zien dat de verbranding van de verbranding varieert met 654 kJ/mol. Dit betekent dat elke cho2 die aan de ketting wordt toegevoegd, verhoogt de verbrandwarmte met een snelheid van 654 kJ/mol. Dus de nonano, ch3(Ch2))7Ch3, Het zal een verbrandingswarmte hebben gelijk aan 6125 kJ/mol (5471 kJ/mol + 654 kJ/mol).
Dit is hetzelfde als zeggen dat langere ketens grotere potentiële energieën hebben, en daarom zijn ze onstabieler.
Gemeletterde alkanen zijn stabieler dan lineair, en dit wordt afgeleid uit hun verbrandingswarmte. Overweeg nu het geval van drie isomeren van het octaan:
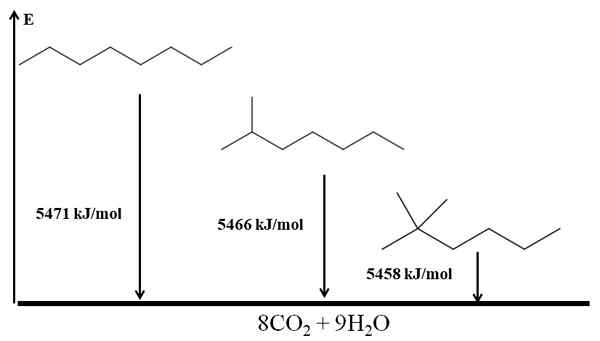 Verbranding verwarmt voor drie octaanisomeren. Bron: Gabriel Bolívar via Molview.
Verbranding verwarmt voor drie octaanisomeren. Bron: Gabriel Bolívar via Molview. Hij N-Octano is het meest onstabiel omdat de verbrandingswarmte de grootste is (5471 kJ/mol). Aan de andere kant, de isomeren 2-methylheptano en 2.2-dimethylhexan. De 2.2-dimethylhexan is het meest stabiel omdat het de meest vertakte van de drie isomeren is.
Alkenes
De relatieve stabiliteit van alkenen kan ook worden verkregen uit hun verbrandingswarmte. Denk bijvoorbeeld aan vier butenus -isomeren:
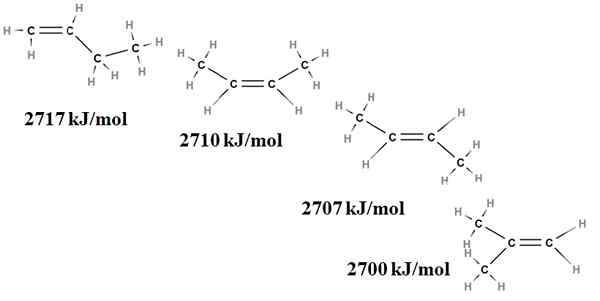 Verbranding verwarmt voor buteno -isomeren. Bron: Gabriel Bolívar via Molview.
Verbranding verwarmt voor buteno -isomeren. Bron: Gabriel Bolívar via Molview. Hier hebben we het niet langer over gevolgen, maar over de mate van vervanging van de dubbele binding, C = C en de spanningen van de van der Waals; dat wil zeggen van elektronische en sterische afstotingen tussen twee omvangrijke groepen die zich aan dezelfde kant van de dubbele binding bevinden.
De eerste isomeer, 1-buteen, is het meest onstabiel omdat de dubbele binding minder is vervangen (h2C = C). Dit wordt weerspiegeld in zijn verbrandingswarmte van 2717 kJ/mol.
Kan u van dienst zijn: chlorogeenzuurRechts, het CIS-2-Buteene, is een beetje stabieler omdat de dubbele binding meer is vervangen. Maar het trans-2-buteen is nog meer nog, want zelfs als het dezelfde mate van vervanging heeft, de groepenkoffers3 van de dubbele binding bevinden zich in transposities, dat wil zeggen aan verschillende zijden van de dubbele binding. Merk op dat de warmte van het trans-2-buteen (2707 kJ/mol) nauwelijks iets lager is dan die van het cis-2-buteen (2710 kJ/mol).
Het laatste isomeer, het 2-methyl-2-buteen, dat ook even is vervangen als de CIS en Trans 2 Bungeo, is toch de meest onstabiele van allemaal. Dit komt omdat beide ch3 Ze worden gevonden in een van de koolstofatomen van de dubbele binding, waardoor ze een alkeen zijn met Cho3 Edelstenen.
Carbonylverbindingen
Evenals de alko's, en andere koolwaterstoffen in het algemeen, zijn de relatieve stabiliteit van de carbonylverbindingen (ketonen, aldehyden, carbonylinezuren) ook gerelateerd aan hun verbrandingswarmte.
Dus, hoe meer gestabiliseerd, of minder reactief hun groepen c = o, minderjarigen zullen hun verbrandingswarmt zijn.
Bijvoorbeeld de verbrandingswarmte van de butanal, CH3Ch2Ch2Cho, het is 2475 kJ/mol. Deze warmte is hoger dan de 2-butanon, CH3Ch2Bedekken3, die gelijk is aan 2442 kJ/mol. Daarom is Butanal onstabieler dan 2-butanone.
In de 2-butanon is de C = O meer gestabiliseerd dankzij de groepen CH3Ch2 en ch3; Ding dat niet gebeurt met de butan, waar een van de groepen nauwelijks een atoom is h.
Referenties
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5e editie. Redactionele addison-wesley inter-Amerikaan.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e editie.)). Wiley Plus.
- Wikipedia. (2020). Verbrandingswarmte. Opgehaald uit: in.Wikipedia.borg
- CK-12 Foundation. Verbrandingswarmte. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- BBC. (2020). Chemische energie: enthalpie van verbranding. Opgehaald uit: BBC.co.Uk
- Steven A. Hardinger. (2017). Geïllustreerde woordenlijst van organische chemie: enthalpie van verbranding. Hersteld van: chem.UCLA.Edu

