Exergonische reactiekenmerken en voorbeelden

- 1299
- 49
- Dewey Powlowski
A exergonische reactie Het is er een die spontaan voorkomt en die in het algemeen gepaard gaat met een afgifte van energie, hetzij in de vorm van warmte, licht of geluid. Wanneer warmte wordt vrijgegeven, wordt gezegd dat we geconfronteerd worden met een exotherme en exergonische reactie.
Dat is de reden waarom de 'exotherme' en 'exergonische' voorwaarden verward zijn en ten onrechte worden behandeld als synoniemen. Dit komt omdat veel exotherme reacties ook exergonisch zijn. Daarom, als een grote onthechting van warmte en licht wordt waargenomen, zoals de oorsprong van een vuur, kan worden aangenomen dat het bestaat uit een exergonische reactie.
 Houtverbranding is een voorbeeld van een exotherme en tegelijkertijd exergonische reactie. Bron: Pixnio.
Houtverbranding is een voorbeeld van een exotherme en tegelijkertijd exergonische reactie. Bron: Pixnio. De vrijgegeven energie kan echter onopgemerkt blijven en niet zo verrassend zijn. Een vloeibaar medium kan bijvoorbeeld iets opwarmen en toch een gevolg zijn van een exergonische reactie. In sommige exergonische reacties die te langzaam passeren, wordt de laagste temperatuurstijging niet eens waargenomen.
Het centrale en karakteristieke punt van dit type thermodynamische reacties is de afname van Gibbs -vrije energie in producten met betrekking tot reagentia, wat zich vertaalt in spontaniteit.
[TOC]
Kenmerken van exergonische reacties
Algemeen diagram
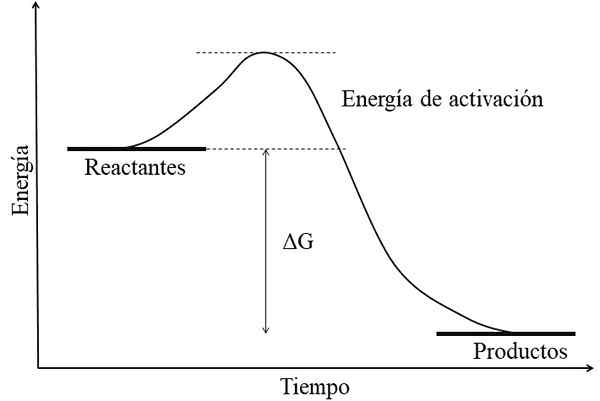 Energiediagram voor een exergonische reactie. Bron: Gabriel Bolívar.
Energiediagram voor een exergonische reactie. Bron: Gabriel Bolívar. Het belangrijkste kenmerk van een exergonische reactie is dat de producten vrije energieën van GIBS's lager hebben dan die van reactanten of reagentia (superieur beeld). Dit feit wordt meestal geassocieerd met de producten zijn chemisch stabieler, met sterkere links, meer dynamische structuren of meer "comfortabele" omstandigheden.
Daarom is dit energieverschil, ΔG, negatief (ΔG < 0). Al ser negativa, la reacción en teoría debe ser espontánea. Sin embargo, otros factores también definen dicha espontaneidad, como lo son la energía de activación (la altura de la colina), la temperatura, y los cambios de entalpía y entropía.
Kan u van dienst zijn: een homogeen systeemAl deze variabelen die reageren op de aard van het fenomeen of de overwogen chemische reactie, laten u bepalen of een reactie al dan niet exergonisch zal zijn. En het zal ook zien dat het niet noodzakelijkerwijs een exotherme reactie hoeft te zijn.
Wanneer de activeringsenergie erg hoog is, vereisen de reactanten de hulp van een katalysator om die energiebarrière te verminderen. Daarom zijn er exergonische reacties die worden gegeven met zeer lage snelheden, of die in de eerste plaats helemaal niet voorkomen.
Vrije energie -afname van het systeem
De volgende wiskundige uitdrukking omvat wat hierboven wordt opgemerkt:
Δg = ΔH - Tδs
De term ΔH is positief als het een endotherme reactie is, en negatief als deze exotherme is. Als we willen dat ΔG negatief is, moet de term Tδs erg groot en positief zijn, zodat bij het aftrekken van ΔH het resultaat van de bewerking ook negatief is.
Daarom, en dit is een ander speciaal kenmerk van exergonische reacties: ze impliceren een grote verandering in systeemtropie.
Dus rekening houdend met alle voorwaarden, kunnen we aanwezig zijn vóór een exergonische reactie, maar tegelijkertijd endotherm; dat is, met ΔH positief, een zeer hoge temperatuur, of een verandering van grote entropie.
De meeste exergonische reacties zijn ook exotherme, omdat als AH negatief is, en door een andere nog meer negatieve term af te trekken, zullen we bijgevolg een AG hebben met negatieve waarde; Tenzij Tδs negatief is (entropie daalt af), en daarom zou de exotherme reactie endogonisch worden (niet spontaan).
Het is belangrijk om te benadrukken dat de spontaniteit van een reactie (exergonisch of niet), sterk afhangt van de thermodynamische omstandigheden; Terwijl de snelheid waarmee het voorbijgaat, te wijten is aan kinetische factoren.
Het kan u van dienst zijn: Living Matter: Concept, Kenmerken en voorbeeldenSpontaniteit van een exergonische reactie
Wat er is gezegd, is bekend, omdat een exergonische reactie spontaan is, of exotherme. Een verbinding kan bijvoorbeeld oplossen bij het koelen van waterkoeling samen met de container. Dit oplossingsproces is endotherm, maar als het spontaan gebeurt, wordt gezegd dat het exergonisch is.
Exotherme reactie
Er zijn "meer exergonische" reacties dan andere. Om erachter te komen, moet de volgende uitdrukking bij de hand zijn:
Δg = ΔH - Tδs
De meest exergonische reacties zijn die die spontaan worden gegeven aan alle temperaturen. Dat wil zeggen, ongeacht de waarde van t in de vorige expressie, is ΔH negatief en δs positief (ΔH 0). Het zijn daarom zeer exotherme reacties, die het eerste idee niet tegenspreken.
Er kunnen ook exotherme reacties zijn waar systeemtropie afneemt (AS < 0); tal como sucede en la síntesis de macromoléculas o polímeros. En este caso, son reacciones exergónicas solamente a bajas temperaturas, ya que de lo contrario el término TΔS sería muy grande y negativo.
Endotherme reactie
Aan de andere kant zijn er reacties die alleen spontaan zijn bij hoge temperaturen: wanneer AH positief en AS positief is (ΔH> 0 en δs> 0). We praten over endothermische reacties. Dat is de reden waarom temperatuurafzuigers spontaan kunnen optreden, omdat ze een toename van entropie dragen.
Ondertussen zijn er reacties die helemaal niet exergonisch zijn: wanneer AH en AS positieve waarden hebben. In dit geval, ongeacht de temperatuur, zal de reactie nooit spontaan optreden. We praten dan met een einde -spontane endaire reactie.
Kan u van dienst zijn: verspreidingsfaseVoorbeelden van exergonische reacties
Chemie wordt meestal gekenmerkt door explosief en briljant te zijn, dus wordt aangenomen dat de meeste reacties exotherme en exergisch zijn.
Verbrandingen
Exergonische reacties zijn de verbrandingen van alkanen, olefines, aromatische koolwaterstoffen, suikers, enz.
Metaaloxidaxen
Evenzo zijn metalen oxidaties exergonisch, hoewel ze langzamer passeren.
Katabole reacties van het organisme
Er zijn echter andere subtielere processen, die ook exergonisch en zeer belangrijk zijn: de katabole reacties van onze metabolisme. Hier ontbinden macromoleculen die fungeren als energiereservoirs, zichzelf bevrijden in hitte en ATP, en dankzij welke het lichaam veel van zijn functies uitvoert.
De meest emblematische van deze reacties is cellulaire ademhaling, tegengesteld aan fotosynthese, waarbij koolhydraten met zuurstof worden "verbrand" om ze te transformeren in kleine moleculen (CO2 en h2O) en energie.
Anderen
Onder andere exergonische reacties hebben we de explosieve ontleding van de stikstof triayoduro, of3; de toevoeging van wateralkalische metalen, gevolgd door een explosie; Polymere synthese van ethoxyleerde harsen; Zuurbasisneutralisaties in waterige oplossing; en luminescente chemo -reacties.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Walter J. Moore. (1963). Fysische chemie. In chemische kinetiek. Vierde editie, Longmans.
- Iran. Levine. (2009). Principes van fysicochemie. Zesde editie, pagina 479-540. MC Graw Hill.
- Wikipedia. (2020). Exergonische reactie. Opgehaald uit: in.Wikipedia.borg
- Helmestine, Anne Marie, pH.D. (16 september 2019). Endergonic versus exergonische reactie en proces. Hersteld van: Thoughtco.com
- Exergonische reactie: definitie en voorbeeld. (18 september 2015). Hersteld van: studie.com
- Khan Academy. (2018). Gratis energie. Hersteld van: is.Khanacademy.borg
- « Mechanische energieformules, concept, typen, voorbeelden, oefeningen
- Duurzame consumptie voor wat het nut is, belang, acties, voorbeelden »

