Wat is chemische kinetiek?

- 625
- 59
- Cecil Graham
We leggen uit wat chemische kinetiek, orde en reactiesnelheid is en de factoren die snelheid beïnvloeden
Wat is chemische kinetiek?
De chemische kinetica Het is de tak van chemie die verantwoordelijk is voor het bestuderen van de snelheid van chemische reacties, welke factoren deze snelheid beïnvloeden en wat zijn de individuele mechanismen of stappen waardoor chemische reacties optreden.
Bovendien stelt het ons in staat om veel aspecten van chemische reacties te begrijpen, zoals chemische balans en activeringsenergie, en bestudeert katalyseprocessen. De laatste maakt het vooral belangrijk in meerdere toepassingen, van biochemie tot industriële engineering.
In het midden van de kinetiek is de reactiesnelheid, die kan worden opgevat als de snelheid waarmee de reagentia worden omgezet in producten. In chemische kinetiek is er echter een veel preciezere definitie.
Definitie van reactiesnelheid
Laten we beginnen met de volgende generieke chemische reactie om de volledige definitie van de reactiesnelheid te geven, zoals gebruikt in chemische kinetiek:
In deze reactie vertegenwoordigen A en B de reagentia, C en D vertegenwoordigen producten, terwijl A, B, C En D Ze vertegenwoordigen de respectieve stoichiometrische coëfficiënten.
De reactiesnelheid (weergegeven met het symbool v) Geeft aan hoe snel. Wiskundig wordt dit als volgt uitgedrukt:
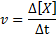
Waarbij 8 [x] de verandering in molaire concentratie van soort x (a, b, c of d) weergeeft in het tijdsinterval Δt.
Het is duidelijk dat hoe sneller een van de reagentia wordt geconsumeerd, hoe sneller de andere reagentia worden geconsumeerd en hoe sneller de producten zullen optreden. Om deze reden is het alleen nodig om de snelheid te definiëren in termen van een van hen.
Het kan u van dienst zijn: methoden voor scheiding van homogene mengselsOm ervoor te zorgen dat het resultaat van de berekening van de snelheid altijd hetzelfde is, ongeacht welke soort de snelheid is gedefinieerd, moet deze altijd worden verdeeld tussen de stoichiometrische coëfficiënt en een teken minder vóór de vergelijking plaatsen als het een reagens is. Het is te zeggen:
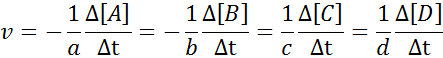
Voorbeeld van definitie van reactiesnelheid
Gezien de volgende chemische reactie:
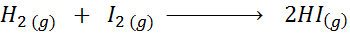
Schrijf de definitie van de reactiesnelheid, afhankelijk van elke betrokken soort.
Oplossing:
In termen van h2:
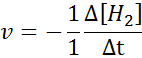
In termen van i2:
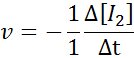
In termen van HI:
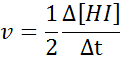
De snelheidswet en de volgorde van reactie
Reacties treden op wanneer atomen en moleculen met elkaar botsen met voldoende energie en een juiste oriëntatie. De kans dat dit gebeurt neemt toe naarmate atomen en moleculen meer geconcentreerd zijn.
Om deze reden hangt snelheid bijna altijd af van de concentratie van reagentia. In sommige gevallen hangt de snelheid ook af van de concentratie van een van de producten, evenals de concentratie van elke katalysator of remmer die aanwezig is in de omgeving.
De wiskundige vergelijking die de snelheid van een reactie op de concentratie van de verschillende betrokken soorten relateert, wordt "genoemd"Snelheid”En in eenvoudigere gevallen heeft het de volgende vorm:
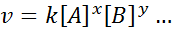
Waar k Het is een evenredigheidsconstante genoemd Snelheid constant, en de exponenten van A, B en alle andere soorten die in de vergelijking verschijnen, worden genoemd Reactieorders.
Volgens de som van alle reactieorders (die globale orde worden genoemd) kunnen verschillende soorten reacties worden onderscheiden. Deze verschillen van hoeveel de concentratie de snelheid beïnvloedt, in de formule van de tijd die nodig is om de helft van de reagentia te consumeren (halfleven) en in de manier waarop de concentratie van de reagentia in de loop van de tijd verandert (de grafieken [a] versus t )).
-
Bestelreacties 0
Wanneer alle exponenten in de snelheidswet 0 zijn, wordt de vergelijking van de snelheidswet verminderd tot:
Kan u van dienst zijn: gecoördineerde covalente link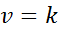
Met andere woorden, het zijn reacties die optreden bij constante snelheid en waarbij de snelheid niet afhankelijk is van de concentratie van een reagens of product.
Bestel grafieken 0
De grafiek van [a] versus t van orde reacties 0 zijn dalende rechte lijnen.
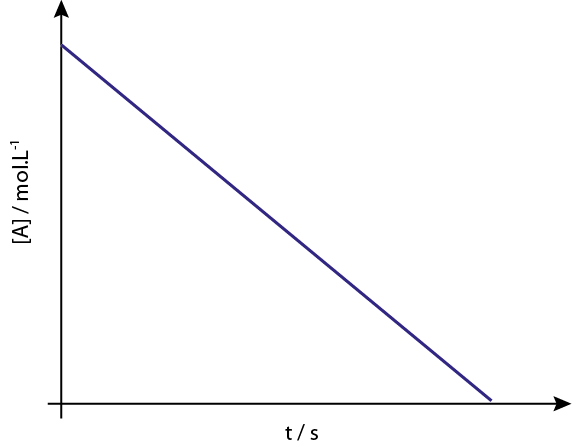
Legend: de concentratiegrafiek versus tijd van een reactie van volgorde 0 geeft een rechte lijn.
Middle Life for Order 0
Voor een reactie van de orde 0, de halve levenstijd (T1/2) Is gegeven door:
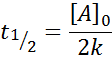
-
1e bestelreacties
In deze reacties varieert de snelheid lineair met de concentratie. De First Order Speed Law is:
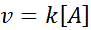
Eerste bestelling afbeeldingen
De grafiek van [A] versus T van de eerste -orderreacties zijn dalende hyperbolen. Als het Neperiaanse logaritme van concentratie (Ln [a]) versus tijd echter grafiek is, wordt een rechte lijn verkregen.
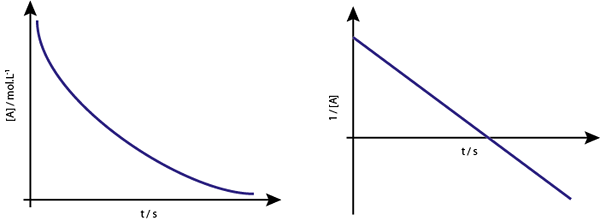 De concentratiegrafiek versus tijd van een reactie van orde 1 geeft een hyperbool, maar de grafiek van de Neperiaanse logaritme van de concentratie versus tijd geeft een lijn
De concentratiegrafiek versus tijd van een reactie van orde 1 geeft een hyperbool, maar de grafiek van de Neperiaanse logaritme van de concentratie versus tijd geeft een lijn Middle Life for First -Order Reactions
Voor een reactie van orde 1, T1/2 Het hangt niet af van de initiële concentratie en wordt gegeven door:
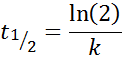
-
Tweede orde reacties
Een reactie kan de tweede orde zijn ten opzichte van een enkel reagens, of eerste orde met betrekking tot twee reagentia. In het eerste geval wordt de snelheidswet gegeven door:
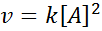
Tweede orde afbeeldingen
De grafiek van [a] versus t van de tweede -orderreacties zijn dalende hyperbolen. Als echter de omgekeerde van de concentratie (1/[a]) versus tijd wordt uitgezet, wordt een rechte lijn verkregen.
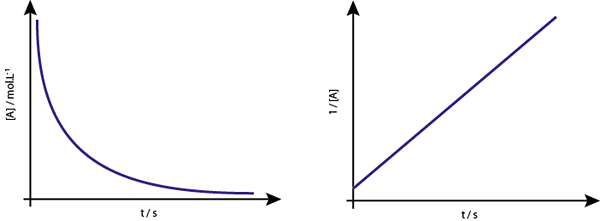 De concentratiegrafiek versus tijd van een reactie van volgorde 2 geeft een curve vergelijkbaar met een dalende hyperbool, maar de grafiek van de concentratie versus tijd geeft een lijn
De concentratiegrafiek versus tijd van een reactie van volgorde 2 geeft een curve vergelijkbaar met een dalende hyperbool, maar de grafiek van de concentratie versus tijd geeft een lijn Middle Life for Second Order Reactions
Voor een reactie van volgorde 2, T1/2 Is gegeven door:
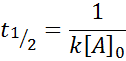
Factoren die de reactiesnelheid beïnvloeden
Temperatuur
De temperatuur verhoogt altijd de snelheid waarmee de reacties optreden, omdat de frequentie en energie waarmee de moleculen met elkaar botsen toeneemt. De afhankelijkheid van de reactiesnelheid met de temperatuur wordt gegeven door de Arrhenius -vergelijking.
Het kan u van dienst zijn: magnesiumhydride: structuur, eigenschappen en gebruikDruk
Toenemende druk is gelijk aan het verhogen van de concentratie van alle soorten in het reactiemedium (voor gasfasreacties), dus de drukverhogingen hebben de neiging om de snelheid van reacties te verhogen.
Katalysatoren
Katalysatoren zijn chemische stoffen die aan het medium worden toegevoegd om de reactiesnelheid te verhogen. De meeste katalysatoren werken door het reactiemechanisme te veranderen door een die lagere activeringsenergie vereist.
Veelvoorkomende katalysatorvoorbeelden zijn enzymen in levende systemen en sommige metalen zoals platina en paladium.
Remmers
Remmers zijn het tegenovergestelde van katalysatoren. Het zijn stoffen die reacties langzamer maken. Anticorrosive zijn voorbeelden van remmers die proberen de snelheid van corrosiereacties te verminderen, om metaaloppervlakken meer te maken.


