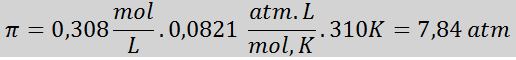Coligatieve eigenschappen van oplossingen
- 2172
- 431
- Lonnie Rohan
Wat zijn coligatieve eigenschappen?
De Colligatieve eigenschappen, Ook wel collectieve eigenschappen van oplossingen genoemd, ze zijn een groep van vier eigenschappen die uitsluitend afhangen van de hoeveelheid deeltjes in de oplossing, maar niet van de aard van deze deeltjes.
Met andere woorden, deze eigenschappen komen voort uit de aanwezigheid van andere deeltjes dan het oplosmiddel, dat wil zeggen deeltjes van de opgeloste stof, maar zijn niet afhankelijk van wie de opgeloste stof is. Elk type deeltje kan aanleiding geven tot coligatieve eigenschappen, ongeacht of het atomen, ionen of moleculen zijn. Het enige dat ertoe doet, is uw concentratie.
De coligatieve eigenschappen zijn vier:
- Besluit van de stoomdruk van het oplosmiddel
- Ebulloscopische hoogte
- Crioscopische afdaling
- Osmotische druk
Allen worden gekenmerkt door evenredig te zijn met de concentratie van de opgeloste stof in het geval van relatief verdunde oplossingen (concentratie <0,2 M). Para soluciones más concentradas, el comportamiento se torna más complejo y difícil de analizar.
Laten we elk van deze vier eigenschappen in detail bekijken:
1. Besluit van de stoomdruk van het oplosmiddel
Wanneer een niet -vluchtige oplossing opgeloste oplossing wordt bereid, is de stoomdruk van de resulterende oplossing altijd lager dan de dampdruk van het zuivere oplosmiddel. Met andere woorden, oplossen van een niet -vluchtige opgeloste stof in een oplosmiddel, veroorzaakt een afname van de dampdruk van dit oplosmiddel, vergeleken met het pure oplosmiddel.
Formule van stoomdruk afname
Zoals alle coligatieve eigenschappen, is de afname van de stoomdruk (DP) evenredig met de concentratie van de opgeloste stof. Door de wet van Raault te combineren met de molaire fractievergelijkingen, kan worden aangetoond dat DP wordt gegeven door:
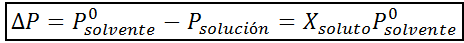
Waar P °oplosmiddel vertegenwoordigt de dampdruk van het zuivere oplosmiddel bij een bepaalde temperatuur, poplossing komt overeen met de dampdruk van de oplossing en xopgeloste stof vertegenwoordigt de concentratie van de opgeloste stof uitgedrukt als molaire fractie.
Waarom de stoomdruk verlaagt met de opgeloste stof?
De kracht die de meeste natuurlijke processen aandrijft, zoals de verdamping van een oplosmiddel, is de toename van de entropie of het niveau van de wanorde. Wanneer een vloeistof verdampt, gaat deze van een zeer geordende toestand (in de vloeistof) naar een zeer rommelig (in gas), omdat er in de gasfase veel meer bewegingsvrijheid is.
Kan u van dienst zijn: violet glasIn een oplossing voegt de aanwezigheid van de opgeloste stoornis echter stoornis toe aan de vloeibare fase, zonder de gasfase te beïnvloeden (omdat de opgeloste stof niet verdampt).
Om deze reden is het verschil in het niveau van wanorde tussen de oplossing en de gasfase minder dan tussen het zuivere oplosmiddel en de gasfase, dus het oplosmiddel heeft minder de neiging om in het tweede geval te verdampen.
Voorbeeld
Probleem: Wetende dat de waterdampdruk bij een bepaalde temperatuur 30,55 mmHg is, bepaalt u de dampdruk van een voorbereide oplossing die 7,20 gram glucose (molmassa of mm = 180 g/mol) in 360 g water (mm = 18,0 g/mol) oplost. bij dezelfde temperatuur.
Oplossing: In dit geval moet de molaire fractie van de opgeloste stof eerst worden berekend. We hebben hier al alle nodige gegevens voor:
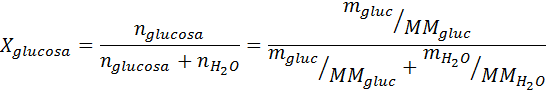
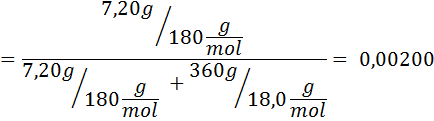
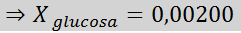
Dan wordt de vergelijking van de stoomdruk afname toegepast.
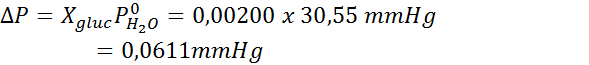
Nu bepalen we de nieuwe stoomdruk van het oplosmiddel:
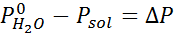
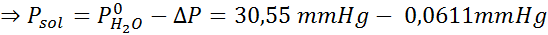
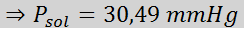
2. Ebullloscopische hoogte of kookpunt
Ebullloscopische hoogte verwijst naar de toename van het kookpunt van een oplossing in vergelijking met het kookpunt van puur oplosmiddel. Om te begrijpen waarom dit gebeurt, onthoud dan dat het kookpunt wordt gedefinieerd als de temperatuur waarbij de dampdruk van een vloeistof gelijk is aan atmosferische druk.
Aangezien de oplossingen een kleinere stoomdruk hebben dan het zuivere oplosmiddel (zoals we net in de vorige sectie hebben gezien), is het noodzakelijk om het meer te verwarmen om de atmosferische druk te kunnen bereiken en zo zijn kookpunt te bereiken. Om deze reden is het kookpunt van de oplossingen (met niet -vluchtige opgeloste opgeloste stoffen) altijd groter dan dat van de pure oplosmiddel.
Ebullloscopische hoogteformule
De toename van het kookpunt (dtB) Het is evenredig met de concentratie van de opgeloste stof die wordt uitgedrukt in de moleliteit, zoals aangegeven door de volgende vergelijking:
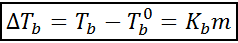
Waar TB Het is het kookpunt van de oplossing, tB° Het is het kookpunt van puur oplosmiddel, kB Het is de ebullloscopische constante van het oplosmiddel en M Het is de molealiteit van de opgeloste stof.
Voorbeeld
Probleem: Weten dat de kookconstante van water 0,52 ° C is.kg/mol, bepaal het kookpunt van de glucoseoplossing bereid in het vorige voorbeeld.
Oplossing: Om de ebullloscopische hoogte te bepalen, hebben we alleen maar moraliteit nodig.
Kan u dienen: tinoxide (ii): structuur, eigenschappen, nomenclatuur, gebruik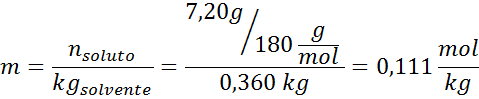
Nu passen we de DT -formule toeB:
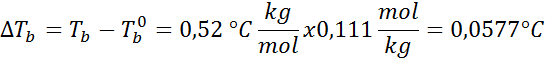
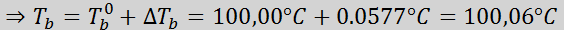
3. Crioscopische afdaling
De cryoscopische afname is de afname van het vriespunt van een oplossing in vergelijking met het vriespunt van het pure oplosmiddel. De reden dat dit gebeurt is vergelijkbaar met de ebullloscopische toename en heeft zijn oorsprong in de afname van de stoomdruk.
Deze eigenschap wordt op grote schaal gebruikt bij koud weer, waar het in de winter sneeuwt. In deze landen is het heel gebruikelijk om vrachtwagens te zien die zouten zoals NaCl of CaCl verspreiden2 op wegen of op openbare banken, waarna sneeuw smelt. De reden dat het smelt, is dat zout het bevriezenpunt van het water vermindert.
Crioscopische afdalingsformule
De chrioscopische afkomstvergelijking lijkt erg op die van de ebullloscopische toename. Het is ook evenredig met de morele concentratie en hangt in dit geval af van een cryoscopische constante van het oplosmiddel.
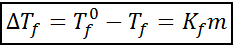
waar TF Het is het vriespunt van de oplossing, tF° Het is het vriespunt van puur oplosmiddel, kF Het is de chrioscopische constante van het oplosmiddel en M Het is de molealiteit van de opgeloste stof.
Voorbeeld
Probleem: Wetende dat de cryoscopische waterconstante 1,86 ° C is.kg/mol, bepaal het vriespunt van de glucoseoplossing bereid in het vorige voorbeeld.
Oplossing: De moraliteit van de oplossing was al bepaald, dus we kunnen DT rechtstreeks bepalenF met behulp van de vorige formule:
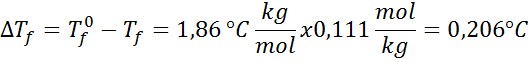
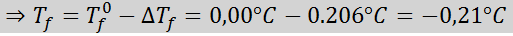
4. Osmotische druk
Osmose is een proces van groot belang op chemisch en biologisch niveau. Dit bestaat uit de stroom van oplosmiddelmoleculen (bijvoorbeeld water) van een verdunde oplossing naar een andere meer geconcentreerde oplossing wanneer ze worden gescheiden door middel van een semipermeabiel membraan (waardoor het oplosmiddel alleen maar kan passeren, maar niet de opgeloste stof).
Deze neiging om oplosmiddel door een semipermeabiel membraan te "absorberen" is een eigenschap die alleen afhankelijk is van de totale concentratie van opgeloste stofdeeltjes in de oplossing, ongeacht welke opgeloste stof het is. Om deze reden is deze trend een coligatieve eigenschap en wordt het gemeten door osmotische druk.
Osmotische druk (π) is de druk die moet worden uitgeoefend op een oplossing om de osmose te stoppen. Hoe groter de osmotische druk, hoe meer neiging de oplossing om oplosmiddel te absorberen (of, meer precies, hoe meer trend het oplosmiddel naar die oplossing verspreidt) de oplossing heeft).
Kan u van dienst zijn: magnesium: geschiedenis, structuur, eigenschappen, reacties, gebruikWaarom komt osmose op??
De verklaring achter het osmoseproces is heel eenvoudig. Alle stoffen hebben de neiging zich te verspreiden van waar ze meer geconcentreerd zijn waar ze meer verdund zijn. Dit wordt verteld om uw concentratiegradiënt te volgen.
Wanneer een oplossing meer geconcentreerd is in opgeloste stof, wordt deze tegelijkertijd meer verdund in oplosmiddel en vice versa. Om deze reden heeft het oplosmiddel een natuurlijke neiging om te gaan van de meest verdunde oplossing (waarbij het oplosmiddel meer geconcentreerd is) naar de meest geconcentreerde oplossing (waar het meer verdund is).
Osmotische drukformule
Osmotische druk kan worden berekend met een formule die erg lijkt op de vergelijking van ideale gassen:
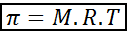
In deze vergelijking is π de osmotische druk, m is de molaire concentratie van de opgeloste stof, r is de universele constante van ideale gassen (0,0821 atm.L/mol.K) en t is de absolute temperatuur in k.
Osmotische druk en toniciteit
Osmotische druk is erg belangrijk voor het functioneren van het menselijk lichaam. In feite worden de zoutoplossingen die intraveneus worden geïnjecteerd geclassificeerd volgens of hun osmotische druk groter is, gelijk aan of minder dan die van bloedplasma aan wat toniciteit wordt genoemd.
- Een minder geconcentreerde oplossing dat plasma een lagere osmotische druk heeft en wordt verteld Hypotone oplossing.
- Als u dezelfde totale concentratie opgeloste opgeloste stof hebt Isotone oplossing.
- Als u een grotere osmotische (of concentratie) druk heeft, wordt verteld hypertonische oplossing.
Voorbeeld
Probleem: Bereken de osmotische druk bij 310 K van een 0,9% zoutoplossing (m/v), die isotoon is met bloedplasma.
Oplossing: We hebben al de temperatuur, dus het enige dat ontbreekt is om de molaire concentratie van de zoutdeeltjes (NaCl) in de oplossing te bepalen. Voor deze.
Elke 100 ml oplossing bevat 0,9 g NaCl, dus:
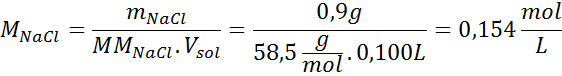
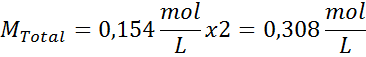
Dit is de totale concentratie van opgeloste deeltjes in de oplossing, dus nu kunnen we de osmotische druk berekenen: