Intermoleculaire krachten
- 4453
- 1021
- Alton D'Amore
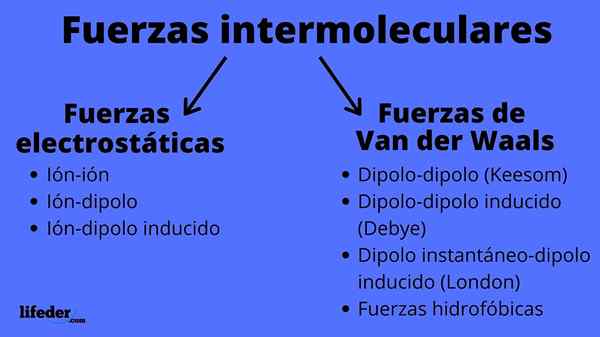
 Schema van typen intermoleculaire krachten
Schema van typen intermoleculaire krachten Wat zijn intermoleculaire krachten?
De Intermoleculaire krachten Ze zijn een reeks interacties die plaatsvinden tussen de moleculen, of van dezelfde chemische verbinding of niet, en die ze bij elkaar houden. Dankzij deze krachten slagen de moleculen erin om een vaste stof, vloeistof of gas te groeperen en te definiëren; dat wil zeggen, ze zijn verantwoordelijk voor de fysieke eigenschappen van stoffen.
Intermoleculaire krachten kunnen van twee soorten zijn: elektrostatische of van der Waals. De elektrostatische zijn allemaal die we ionen hebben, die elektrisch geladen atomen of moleculen zijn (+ of -). Ondertussen omvatten die van van der Waals neutrale atomen of moleculen, die door schommelingen in hun elektronische verdeling worden gepolariseerd en aangetrokken of met elkaar afgestoten worden.
Intermoleculaire krachten kunnen worden vergeleken met de bestaande unie tussen verschillende stukken leken. Afhankelijk van hun vormen en richtlijnen worden hun vakbonden zwakker of zwakker, net zoals ze het ontwerp en de uiteindelijke dimensies van de constructie veranderen.
Hoe sterker deze krachten zijn, hoe moeilijker het zal zijn om de stukken leken te scheiden of, in het geval van chemie, de moleculen. Dit betekent ook dat er een grotere verdichting zal zijn en dat de moleculen daarom meer viskeuze vloeistoffen, zwaardere of dichtere gassen zullen definiëren.
Andere fysieke eigenschappen zoals fusie- en kookpunten, volatiliteit, textuur, enz., Het zijn ook macroscopische reflexen van de intermoleculaire krachten die regeren tussen de moleculen of ionen van een verbinding of mengsels. Bijvoorbeeld: de intermoleculaire krachten van de gassen zijn erg zwak in vergelijking met die van een steen.
Inzicht in intermoleculaire krachten is essentieel om veel van de chemische, fysische en biologische concepten te beschrijven.
Elektrostatische krachten
Ion-ion
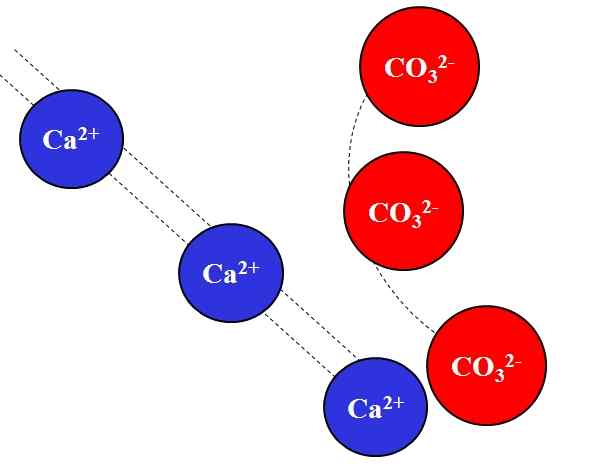 Elektrostatische aantrekkingskracht tussen Ca2+ en Co32 -ionen-. Bron: Gabriel Bolívar.
Elektrostatische aantrekkingskracht tussen Ca2+ en Co32 -ionen-. Bron: Gabriel Bolívar. Tegengestelde ladingen die ionen aantrekken met grote kracht, wat te wijten is aan de wet van Coulomb, en verlaagt snel de meer de ionen die zich verplaatsen.
Bijvoorbeeld het CA -ion2+ Het is een positieve lading, een kation, terwijl de CO32- Het is een negatieve belasting, een anion. Je tegengestelde ladingen zijn, ca2+ en co32- Ze trekken elkaar aan en bewijzen dat hoe dichter ze zijn, hoe meer ze samen zullen blijven.
Integendeel, ionen met dezelfde belasting, positief of negatief, stoten af met dezelfde kracht maar in de tegenovergestelde zin. Dus de CA2+ Afstoten aan ionen zoals Na+, Mg2+, K+, enz., Tenzij er andere anionen zijn die de afstoting verminderen.
Het kan u van dienst zijn: dibenzalacetona: eigenschappen, reactiemechanisme, gebruik, risico'sVan alle intermoleculaire krachten is die van het type ionen-ion de eenvoudigste; Maar tegelijkertijd de sterkste van allemaal. Er is veel energie of warmte nodig om de ionen te scheiden.
Ion-dipolo
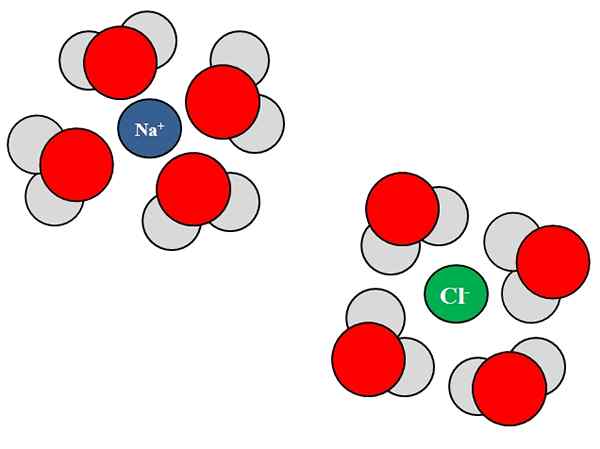 Ion-dipolo-interacties tussen watermoleculen en NaCl-ionen. Bron: Gabriel Bolívar.
Ion-dipolo-interacties tussen watermoleculen en NaCl-ionen. Bron: Gabriel Bolívar. Iones kunnen ook interageren met neutrale atomen of moleculen, zoals water. Dit is vooral het geval als het gaat om de moleculen van een oplosmiddel, die Solvata, dat wil zeggen, de ionen in hun vloeistof omringt.
Natriumchloride, NaCl, bestaat bijvoorbeeld uit na ionen+ en Cl-. Wanneer hun kristallen in het water worden gegooid, de watermoleculen, h2O of hoh, hydrateer of omringen de ionen van NaCl; Maar de manier waarop ze dat doen, is afhankelijk van het betreffende ionen.
Daarom zien we in het superieure beeld dat de ion na+ wordt gehydrateerd door H H zuurstofatomen2OF. Ondertussen, de ion CL- wordt gehydrateerd door waterstofatomen.
Omdat? Omdat water een polaire stof is, wat betekent dat het een dipool heeft: een pool met een positieve gedeeltelijke belasting en een andere met een negatieve gedeeltelijke belasting.
Het zuurstofatoom, omdat het meer elektronegatief is, trekt de elektronen naar zichzelf aan, waardoor de elektronen vaker rond dat atoom worden gevonden; iets dat niet hetzelfde gebeurt met waterstofatomen, minder elektronegatief. Zuurstof, omdat het negatiever is, is gericht op NA+; Terwijl hydrogenen, omdat ze positiever zijn, gericht zijn op de CL-, Omdat tegengestelde ladingen worden aangetrokken.
Geïnduceerde ion-dipolo
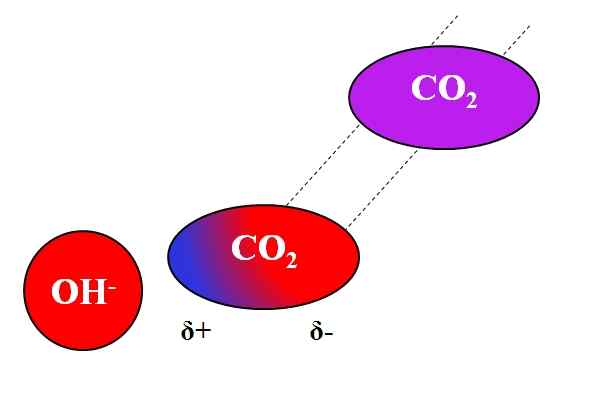 Inductieve actie oh- op het co₂ molecuul. Bron: Gabriel Bolívar.
Inductieve actie oh- op het co₂ molecuul. Bron: Gabriel Bolívar. Niet alleen polaire of dipolen moleculen kunnen interageren met ionen. Voor neutrale atomen of moleculen, zelfs als ze geen dipolen hebben, is de verdeling van hun elektronen vatbaar voor de inductieve effecten van nabijgelegen ionen; dat wil zeggen, de ionen veroorzaken een tijdelijke en korte polarisatie, genoeg voor een opmerkelijke interactie.
Kan u van dienst zijn: loodacetaat: structuur, eigenschappen, verkrijgen, gebruikStel bijvoorbeeld dat de interactie tussen OH ION- en de CO2. De CO2 Het is een neutrale verbinding, waarvan het molecuul (in paars) dipool mist. Aangezien oh echter nadert-, De negatieve belasting van deze afstoting aan de elektronen van de zuurstofatomen van de CO2.
Hoe dichter de oh is- en de CO2, Sterker zal afstoting zijn. Bijgevolg begint een dipool veroorzaakt door de OH te worden gevestigd- Over Co2. Een positieve pool verschijnt Δ+ omdat elektronen, afgestoten, "emigreren" naar het andere uiteinde van de molecuul.
Dus oh- en de CO2 Ze blijven voldoende samen om met elkaar te reageren. Dit is de reden waarom CO2 Het is bijzonder oplosbaar in alkalische oplossingen.
Van der Waals Forces
Van der Waals 'krachten verwijzen in principe alleen naar degenen die bestaan tussen neutrale atomen of moleculen, zonder ionische belastingen.
Dipolo-Dipolo (Keesom)
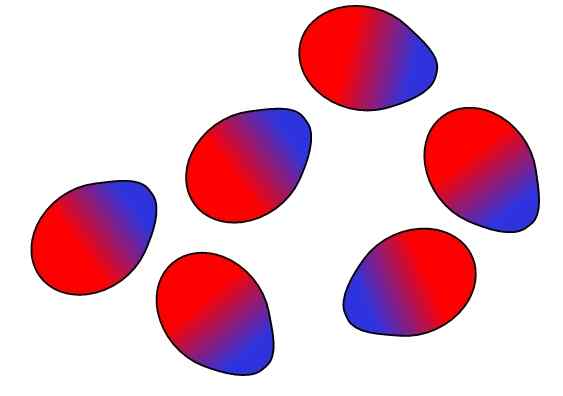 Dipolo-Dipolo Forces. Bron: Gabriel Bolívar.
Dipolo-Dipolo Forces. Bron: Gabriel Bolívar. Tegengestelde ladingen worden aangetrokken, gelijke belastingen afstoten. Hetzelfde geldt voor de dipolen: tegengestelde polen (Δ+ en Δ-) worden aangetrokken, terwijl gelijke polen afstoten. De positieve polen of δ+ worden hierboven weergegeven met de blauwe kleur, maar dat de negatieve polen of Δ- worden weergegeven met de rode kleur.
Merk op hoe de bovenste moleculen zijn georiënteerd en zo geordend dat de tegenovergestelde polen zijn, die in het proces naar dezelfde polen bewegen. Deze ordening is wat bekend staat als de interacties of krachten dipolo-dipolo (Keesom-krachten), en zijn de belangrijkste intermoleculaire krachten tussen polaire moleculen.
Bijvoorbeeld H -moleculen2Of, HCl, HF, CO, onder andere zijn ze in vergelijkbare modi besteld. Hoe meer polair ze zijn, hoe sterker de dipool-dipolo-krachten zullen zijn; En daarom zal het moeilijker zijn om hun moleculen te scheiden.
De HF is meer polair dan de HCl, dus het kookpunt van de HF is superieur (19.5 ºC) tot de HCl (-85.05 ºC). Het is ongelooflijk het effect dat intermoleculaire krachten hebben op fysische eigenschappen. De kleinste variatie en de stof zal zich totaal anders gedragen dan wat werd verwacht.
Kan u van dienst zijn: Gaseous State: kenmerken, algemene wetgeving, voorbeeldenGeïnduceerde Dipolo-Dipolo (Debye)
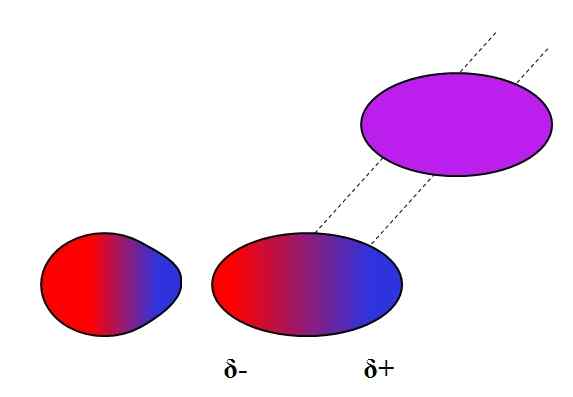 Geïnduceerde dipolo-dipolo. Bron: Gabriel Bolívar.
Geïnduceerde dipolo-dipolo. Bron: Gabriel Bolívar. Dipolos, zoals ionen, kan ook fluctueren of beïnvloeden van de elektronische verdeling van neutrale atomen of moleculen. Zo zien we in het superieure beeld dat een dipool plotseling een neutraal molecuul polariseert. Daarom wordt gezegd dat het een geïnduceerde dipool-dipoolkracht is, omdat de tweede dipool tijdelijk is, niet permanent.
Water kan bijvoorbeeld een kleine hoeveelheid van of oplossen2, Maar genoeg voor mariene fauna om te ademen. Als h2Of kon geen dipool in de O veroorzaken2, Alle zuurstof van de zeeën zou aan het oppervlak ontsnappen, omdat er geen interacties zouden zijn tussen beide moleculen.
Instant Dipolo-geïnduceerde Dipolo (Londen)
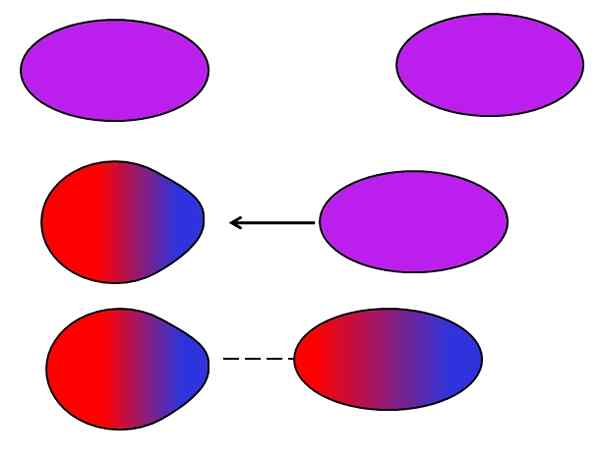 Londense strijdkrachten. Bron: Gabriel Bolívar.
Londense strijdkrachten. Bron: Gabriel Bolívar. Neutrale atomen of moleculen hebben geen aangrenzende ionen of dipolen nodig om voor zichzelf te lijden, schommelingen in de verdeling van hun interne belastingen. De elektronen zijn niet stil, maar bewegen door het molecuul. Op een gegeven moment zal een onmiddellijke dipool plaatsvinden, die als het heel dicht bij een neutraal molecuul of atoom is, een dipool erin zal induceren (zie hierboven).
Hoe groter en asymmetrisch deze moleculen, hoe groter de kans dat de instant dipolen zullen optreden. Dat is de reden waarom de verbindingen van de hoogste atoommassa's een geïnduceerde instant dipol-krachten geïnduceerd hebben. Dit type van der Waals Forces is beter bekend als London Forces.
Bijvoorbeeld edelgassen (HE, NE, AR, enz.) Ze blijven verenigd dankzij de Londense troepen, net als luchtgassen (of2, N2, CO2, enz.)). Ook is deze kracht het meest overheersend bij koolwaterstoffen zoals methaan, cho4, En propaan, Cho3Ch2Ch3.
Hydrofobe krachten
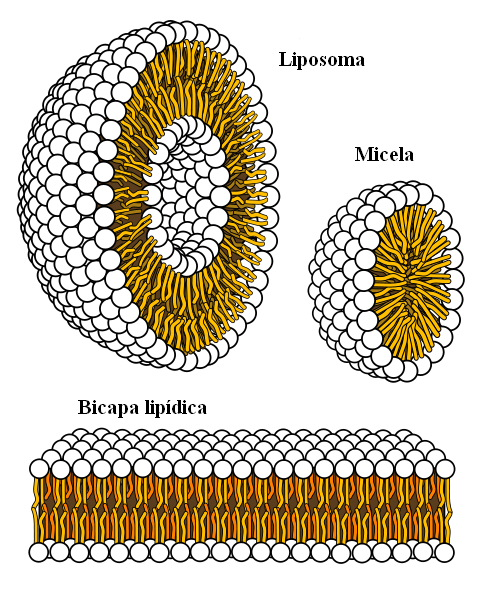 Supramoleculaire structuren zijn afkomstig van hydrofobe krachten
Supramoleculaire structuren zijn afkomstig van hydrofobe krachten Ten slotte hebben we hydrofobe krachten, die een speciaal resultaat zijn van Londense krachten en afstotingen tussen stoffen met verschillende polariteiten. Vetten zijn weinig gerelateerd aan water, dus het is hierin onoplosbaar.
Vetmoleculen proberen zodanig te groeperen dat hun interacties met water zoveel mogelijk zijn, en dit slaagt erin om 3D -structuren te vormen zoals die hierboven worden getoond.
Vetmoleculen, zoals fosfolipiden, komen dus samen om lipide dubbellaags, micellen en liposomen te vormen.
Indien waargenomen, hebben deze moleculen een witte kop die een polair gedeelte vertegenwoordigt, gerelateerd aan water; evenals een apolaire staart, die de watermoleculen afstoot. De lijnen proberen zich in deze supramoleculaire structuren te plaatsen, zodat ze geen interactie aangaan met water.

