Pyridinestructuur, eigenschappen, gebruik, toxiciteit, synthese
- 1874
- 367
- Hugo Crooks
De Pyridine Het is een aromatische amine waarvan de chemische formule c is5H5N. Het is de stikstofversie van benzeen, omdat een groep -ch = is vervangen door een stikstofatoom (n). Samen met de pyrol vormt de pyridine de groep eenvoudiger aromatische amines van allemaal.
Aanvankelijk kwam de pyridine voor uit de Hulla -teer, maar het was een kleine prestatiemethode. Dit leidde tot het creëren van verschillende methoden voor zijn chemische synthese, die de overhand heeft waarin de reactie van de formaldehyde, acetaldehyde en ammoniak wordt gebruikt.
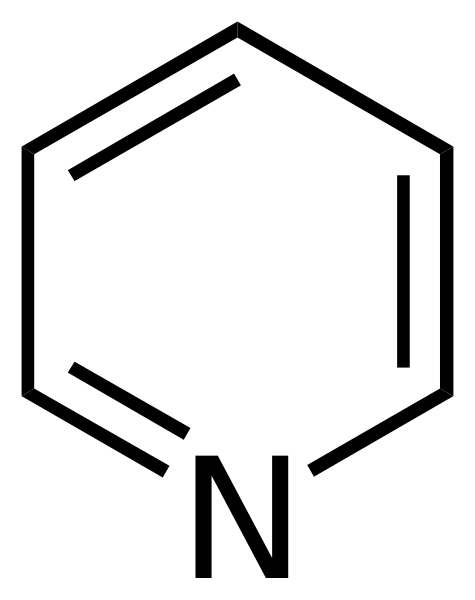 Structurele formule van pyridine. Bron: Calvero. / Publiek domein
Structurele formule van pyridine. Bron: Calvero. / Publiek domein De pyridine werd voor het eerst verkregen door Thomas Anderson (1843), een chemicus escoss, die door de verwarming van dierenvlees en botten een olie produceerde waaruit de pyridine werd gezuiverd.
 Thomas Anderson (juli 1819)
Thomas Anderson (juli 1819) Pyridine wordt gebruikt als grondstof voor de synthese van verbindingen die de proliferatie van insecten, schimmels, kruiden, etc. elimineren en regelen en controleren. Het wordt ook gebruikt bij de uitwerking van talloze medicijnen en vitamines, naast gebruik als een oplosmiddel.
Pyridine is een giftige verbinding die op chronische manier kan schade aan de lever, nieren en het functioneren van het centrale zenuwstelsel. Pyridine kan het lichaam betreden vanwege inname, inademing en verspreiding door de huid. Het is bekend in de chemische stof omdat het een stof is die in staat is hulpeloosheid bij mannen te veroorzaken.
[TOC]
Pyridinestructuur
Moleculair
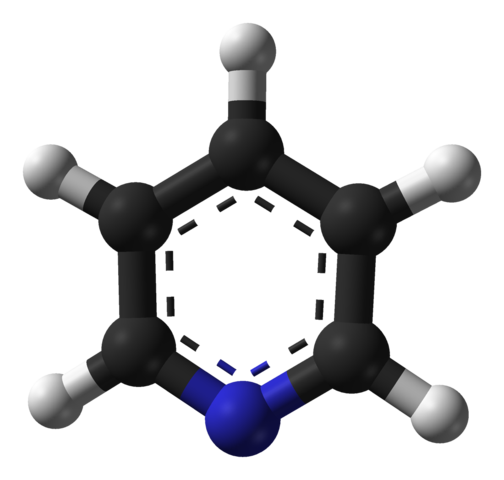 Moleculaire structuur van pyridine. Bron: Benjah-BMM27 / Public Domain
Moleculaire structuur van pyridine. Bron: Benjah-BMM27 / Public Domain Het superieure beeld toont de moleculaire structuur van de pyridine voorgesteld door een model van bollen en balken. Zoals te zien is, lijkt het molecuul erg op dat van benzeen, met het enige verschil dat er een van zijn koolstofatomen (zwarte bollen) is vervangen door stikstof (blauwe bol).
Stikstof, omdat het meer elektronegatief is, trekt elektronische dichtheid naar zichzelf aan, wat een permanent dipoolmoment in de pyridine creëert. Daarom interageren pyridinemoleculen via dipool-dipolo-krachten.
Waterstofatomen zijn de armste gebieden in elektronen, zodat ze worden georiënteerd in de richting van het stikstofatoom van een naburige molecuul.
Kristallijn
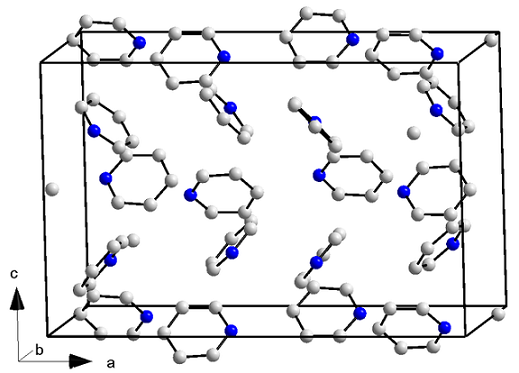
 Kristallijne structuur van pyridine. Bron: orci/cc by-s (https: // creativeCommons.Org/licenties/by-sa/3.0)
Kristallijne structuur van pyridine. Bron: orci/cc by-s (https: // creativeCommons.Org/licenties/by-sa/3.0) Pyridinemoleculen hebben niet alleen dipool-dipolo-krachten, maar ook met interacties van aromatische ringen. Aldus slagen deze moleculen erin zichzelf te positioneren om een ortorrombisch structuurkristal (bovenste beeld) te veroorzaken bij een temperatuur van -41,6 ° C.
Pyridine -eigenschappen
 Pyridinemonster. Lhchem/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0)
Pyridinemonster. Lhchem/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0) Fysiek uiterlijk
Kleurloze vloeistof, met een penetrerende geur, vergelijkbaar met die van vissen.
Kan u van dienst zijn: Redox Balance -methode: stappen, voorbeelden, oefeningenMolaire massa
79.1 g/mol
Dikte
0.9819 g/ml
Smeltpunt
-41,6 ºC
Kookpunt
115.2 ºC
Oplosbaarheid
Het is mengbaar met water, en ook met alcohol, ether, oliether, oliën en veel organische vloeistoffen in het algemeen.
Dampdruk
16 mmHg bij 20 ºC.
Dampdichtheid
2,72 met betrekking tot water = 1
Brekingsindex (nD))
1.5093
Smurrie
0,88 CP
Dipolair moment
2.2 D
ontstekingspunt
21 ºC
Zelfsturingstemperatuur
482 ºC
Ontleding
Wanneer verwarmd tot ontleding straalt een cyaniderook uit.
Corrosie
Pyridine in vloeibare vorm valt enkele vormen van kunststoffen, rubbers en coatings aan.
pH
8,5 (0,2 M oplossing in water)
Basiciteit en reactiviteit
Pyridine is een zwakke basis. Het is een tertiaire amine waarvan 0,2 m oplossing in water een pH van 8,5 produceert. Het heeft weinig affiniteit voor elektronen als gevolg van stikstofelektronegativiteit, zodat hun koolstofatomen meestal geen elektrofiele vervanging lijden.
Pyridine ervaart nucleofiele substitutie, bij voorkeur in posities C4 en C2 Van de ring. Vanwege zijn vermogen om elektronen te doneren, is de pyridine meer oxidatie meer dan benzeen en reageert gewelddadig met zwavelzuur, salpeterzuur en anhydride maleico.
Gebruik van pyridine
Pesticiden
Pyridine is een voorloper van de voorste en diquat herbicide. Op dezelfde manier dient het voor de synthese van het chlorpirifos -insecticide, waarvan de eerste stap de chlorering van de pyridine is. Het is ook de eerste grondstof om het fungicide te verkrijgen op basis van de pyritie.
Oplosmiddel
Pyridine is een polair oplosmiddel, gebruikt voor dealerreacties en antibioticumextractie. Pyridine wordt gebruikt als oplosmiddel in de verf- en rubberindustrie, en ook in onderzoekslaboratoria als oplosmiddel bij de extractie van plantenhormonen.
Geneesmiddel
Pyridine dient als een eerste punt in de synthese van cetilpyridinium en laurilpyridinium, verbindingen die worden gebruikt als antiseptica in orale en tandheelkundige zorgproducten. Het pyridinemolecuul maakt deel uit van de chemische structuur van talloze medicijnen.
Esmeprazol bijvoorbeeld, gebruikt bij de behandeling van gastro -oesofageale reflux. Loratidine is een ander medicijn dat is bereid op basis van pyridine, bekend als Claritin, dat wordt gebruikt als een behandeling van allergische processen.
Pyridine (fenazopyridine) tabletten worden gebruikt bij de symptomatische behandeling van een irritatie van de urinewegen, die in sommige gevallen gepaard gaat. Fenazopyridine is een kleurstof die een analgetische functie in de urinewegen vervult.
Di-acylhidrazine is een pyridinedivaat dat een antibacteriële activiteit heeft die zich uitoefent op gram negatieve bacteriën, zoals EN. coli, en gram positieve bacteriën, zoals S. Albus.
Pyridine dient als basis voor thiazolo [5,4-6] pyridine, samengesteld uit antivirale activiteit, vooral tegen het β-massa-virus van influenza. Het 2-acetylpyridine, een pyridinedivaat, heeft een grote antitumoractiviteit en is een leukemie-remmer.
Kan u van dienst zijn: kwikoxide (hg2o)Anderen
Pyridine wordt gebruikt bij de productie van vitamines, rubberproducten, lijmen, schilderijen en insecticiden. Het wordt ook gebruikt in de denaturatie van alcohol en bij het kleuren van sommige textiel.
20 % van de pyridine wordt gebruikt bij piperidine -voorbereiding. Piperidine komt tussenbeide in vulkanisatie en landbouw.
Pyridine wordt ook gebruikt bij de synthese van polycarboneerde harsen, als een voedselsmaak en als een reagens voor cyanidedetectie.
Toxiciteit
- Pyridine komt in het organisme, voornamelijk als gevolg van inademing en diffusie door de huid. Acute blootstelling aan pyridine kan irritatie en brandwonden veroorzaken in de ogen en huid.
- Pyridine kan dermatitis en allergie in de huid ontstaan. De ontwikkeling van allergie kan worden vergezeld naast jeuk en uitslag.
- Pyridine -inademing kan neus- en keelirritatie veroorzaken, vergezeld van hoesten en een astmatische ademhaling.
- Door inname kan pyridine misselijkheid, braken, diarree en buikpijn veroorzaken. Evenzo kan de opname van een hoge dosis pyridine in het organisme veroorzaken: hoofdpijn, vermoeidheid, vervagen, verbluffend, duizeligheid, verwarring en uiteindelijk eten en de dood.
- De organen die het meest worden getroffen door de werking van de pyridine zijn de lever, de nieren, de mannelijke geslachtsdelen en het centrale zenuwstelsel. Het kan ook op beenmerg werken, waardoor de productie van bloedplaatjes wordt geïnduceerd. Een carcinogene werking van pyridine is niet aangetoond bij dieren.
De OSHA heeft een blootstelling vastgesteld in de lucht van 5 ppm per werkdag van 8 jaar.
Synthese
De eerste methoden voor het verkrijgen van pyridine waren gebaseerd op de extractie van organische materialen. Thomas Anderson (1843) verkregen voor het eerst de pyridine door het verwarmen van vlees en dierenbotten te verwarmen. In een eerste fase produceerde Anderson een olie van waaruit hij de pyridine wist te destilleren.
Traditioneel werd pyridine verkregen uit de hulla teer of kolenvergassing. Deze procedures waren omslachtig en van weinig prestaties, omdat de concentratie van pyridine in deze grondstoffen erg laag was. Een synthesemethode was noodzakelijk.
Chichibabin -methode
Hoewel er veel methoden zijn voor pyridinesynthese, wordt de in 1923 geïntroduceerde chichibabineprocedure nog steeds voornamelijk gebruikt. In deze methode wordt de pyridine gesynthetiseerd uit de reactie van formaldehyde, acetaldehyde en ammoniak, die goedkope reagentia zijn.
Kan u van dienst zijn: Type link van 02In de eerste fase reageren formaldehyde en acetaldehyde om de acroleine -verbinding te vormen, in een condensatiereactie van Knoevegel, die ook water vormt.
 Pyridine -condensatie van acroleína en acetaldehyde
Pyridine -condensatie van acroleína en acetaldehyde Ten slotte reageert Acroleína in een tweede fase met formaldehyde en ammoniak om dihydropyridine te vormen. Vervolgens wordt dihydropyridine geoxideerd tot pyridine in een reactie bij 350 -550 ° C in aanwezigheid van een vaste katalysator, bijvoorbeeld silica -alumina.
Reacties
Elektrofylische substituties
Deze substituties treden meestal niet op als gevolg van lage elektronische pyridinedichtheid.
Sulfanatie heeft een grotere moeilijkheid dan nitratie. Maar bromering en chlorering komen gemakkelijker voor.
Pyridine-N-oxide
De oxidatieplaats in het pyridine is het stikstofatoom, is de oxidatie geproduceerd door de perziken (zuren met een OOH -groep). Stikstofoxidatie bevordert elektrofiele substitutie in koolstofatomen 2 en 4 van pyridine.
Nucleofiele substituties
Pyridine kan verschillende nucleofiele substituties ervaren vanwege de lage elektronische dichtheid van de pyridine -ringkoolvesten. Deze substituties komen gemakkelijker voor in het pyridinemolecuul gemodificeerd door broom, chloor, fluor of sulfonzuur.
De verbindingen uitgevoerd door nucleofiele aanvallen op pyridine zijn meestal: alcoxiden, tyolaten, amines en ammoniak.
Stadelijke reacties
Pyridine kan worden verminderd door radicale reacties. Radicale pyridinedimerisatie wordt uitgevoerd met elementair natrium of nikkel Raney, in staat om 4.4'-bipperidine of 2.2'-bipperidine te produceren.
Reactie op stikstofatoom
Zuren, volgens Lewis, worden gemakkelijk toegevoegd aan het stikstofatoom van pyridine, waardoor pyridinezouten worden gevormd. Pyridine is een Lewis -basis die een paar elektronen schenkt.
Hydrogenering en reductiereactie
Piperidine wordt geproduceerd door de hydrogenering van pyridine met nikkel, kobalt of ruthenium. Deze reactie wordt gemaakt bij hoge temperaturen gepaard met het gebruik van een katalysator.
Referenties
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e Editie.)). Wiley Plus.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Morrison en Boyd. (1987). Organische chemie. (Vijfde editie). Addison-Wesley IberoAmericana.
- Wikipedia. (2020). Pyridine. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2020). Pyridine. PubChem -database., CID = 1049. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Laura Foist. (2020). Pyridine: structuur, formule en fysieke eigenschappen. Studie. Hersteld van: studie.com
- Atof Ali Altaf, Adnan Shahzad, Zarif Gul, Nasir Rasool, Amin Badshah, Bhajan Lal, Ezzat Khan. (2015). Een overzicht van het medicinale belang van pyridinederivaten. Journal of Drug Design and Medicinal Chemistry. Vol. 1, nee. 1, pp. 1-11. Doi: 10.11648/j.JDDMC.20150101.elf
- Webmd. (2020). Pyridinetablet. Opgehaald uit: WebMD.com
- New Jersey Department of Health and Senior Services. (2002). Pyridine. [PDF]. Hersteld van: nj.Gov
- « C ++ geschiedenis, kenmerken, gegevenstypen, voorbeelden
- Essentiële vetzuren functies, belang, nomenclatuur, voorbeelden »

