Waterstofperoxide (H2O2) structuur, eigenschappen, gebruik, verkrijgen

- 2282
- 600
- Dr. Rickey Hudson
Hij waterstof peroxide Het is een anorganische verbinding waarvan de chemische formule h is2OF2. Iedereen is het eenvoudigste peroxide van deze familie van chemische verbindingen. De structurele formule is H-O-O-H, deze interne geoxygeneerde brug is kenmerkend voor alle peroxiden.
In 1818, h2OF2 Het werd geïdentificeerd door Louies Jacques Thénard, die een chemische verbinding voorbereidde die hij toen vroeg Huzigenada. Het is een onstabiele verbinding, ontleedt door blootstelling aan licht, warmte en sommige metalen.
 Chemische formule van waterstofperoxide
Chemische formule van waterstofperoxide Het is een zeer nuttige verbinding die wordt gebruikt bij het desinfectie van kleine wonden, haarbleken, waterbehandeling, enz. Hoewel hij schadelijke acties kan hebben voor de mens, wordt het gevonden in alle eukaryotische cellen van levende wezens, waar hij verschillende nuttige functies uitvoert.
Waterstofperoxide produceert oxidatie van toxische stoffen zoals fenolen, ethanol, formaldehyde, enz., Producten die worden geëlimineerd door de lever en nieren. Bovendien draagt het bij aan de vernietiging van de bacteriën die gefagocyseerd zijn door neutrofielen en macrofaag leukocyten.
[TOC]
Structuur
Molecuul
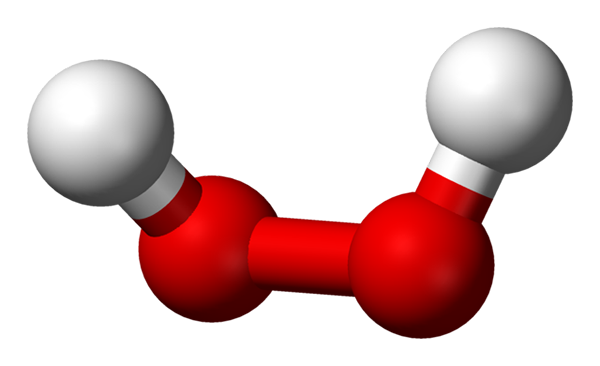 Waterstofperoxidemolecuul vertegenwoordigd met een bollen en stavenmodel. Bron: Benjah-bmm27 via Wikipedia.
Waterstofperoxidemolecuul vertegenwoordigd met een bollen en stavenmodel. Bron: Benjah-bmm27 via Wikipedia. In het superieure beeld is de structuur van het H -molecuul te zien2OF2 (H-O-O-H), met de rode bollen die overeenkomen met zuurstofatomen en witte waterstofatomen. Merk op dat het molecuul niet plat is en dat noch de atomen H zijn overschaduwd in de ruimte (een voor de andere).
Interessant is dat h2OF2 Het is moeilijk om zijn eenvoudige centrale link O-O te roteren, zodat de posities van deze H niet kunnen worden uitgewisseld; De ene zal niet naar beneden gaan terwijl de andere omhoog gaat.
Omdat? Omdat er in de twee zuurstofatomen twee elektronenvrije paren zijn, die in totaal acht zeer nauwe elektronen opleveren en die elkaar afstoten voor hun negatieve ladingen.
Rotatie
Toch zal de O-O-link waarschijnlijk roteren vanwege interacties met zijn omgeving.
Bijvoorbeeld, wanneer samen met de twee duimen, met de vingers uitgestrekt en de anderen gesloten, zoals het trekken van een rechtbank, en vervolgens de duimen zo draaien dat een van de vingers zich naar voren richt en de andere achteruit, zal er een Geschatte weergave van h2OF2.
Als een lichaam een van de indices speelt, zullen de duimen roteren als reactie op deze interactie; Ze zullen echter onmiddellijk terugkeren naar hun oorspronkelijke positie vanwege de hierboven genoemde elektronische afstotingen. Deze rotaties omlijsten de dynamische aspecten van deze molecuul.
Intermoleculaire interacties
In de vloeibare toestand de h2OF2 slaagt erin om waterstofbruggen vast te stellen (HOOH-O2H2), anders zou het hoge kookpunt (150 ºC) niet worden uitgelegd in vergelijking met het water.
Kan u van dienst zijn: calciumsulfaat (case4): chemische structuur, eigenschappen, gebruikZodra het naar de gasfase gaat, de M -moleculen2OF2 Vermoedelijk kan niet langer dergelijke bruggen vormen, niet alleen tot de grootste intermoleculaire afstand, maar ook de waterstofatomen zouden de eerste zijn die in het geval van botsingen wordt aangeraakt (dit kan worden gevisualiseerd door terug te nemen naar het vingersmodel).
Ondertussen is in vaste fase de hoek van de vlakken die de h vaststellen 90º (plaats de loodrechte vingers) vingers). Nu worden waterstofbruggen nog belangrijker en H -moleculen2OF2 Ze zijn geordend in een tetragonale structuur kristal.
Eigenschappen
Sbotella met waterstofperoxide. Bij apotheken wordt het bereikt met een concentratie van 3% m/v. Bron: Pixnio.
Namen
-Waterstof peroxide
-Dioxidano
-Oxidanol
-Perhydoxinezuur
-O-hydroxyol
-Waterstof peroxide
Molaire massa
34,0147 g/mol
Fysiek uiterlijk
Lichtblauw (geconcentreerd) of kleurloos. Het is iets meer viskeus en dichter dan water. Het wordt gedistilleerd voor veiligheid bij lage temperaturen en verminderde druk, omdat het ontleedt door explosief te verwarmen.
Geur
Acute of een geur vergelijkbaar met ozon.
Smaak
Bitter
Dikte
Vaste 1,71 g/cm3
De dichtheden van hun waterige oplossingen zijn afhankelijk van hun concentratie; 27 % heeft bijvoorbeeld een dichtheid van 1,10 g/cm3, terwijl 50 %, 1,13 g/cm3
Smeltpunt
- 0,43 ºC
Kookpunt
150.2 ºC. Deze waarde is verkregen door extrapolatie, omdat waterstofperoxide ontleedt bij hoge temperaturen.
Oplosbaarheid in water
Mengbaar ≥ 100 mg/ml bij 25 ° C
Oplosbaarheid
Het is oplosbaar in ether en alcoholen, maar onoplosbaar in oliether. Het ontleedt in water en zuurstof in veel organische oplosmiddelen.
Octanol/waterpartitiecoëfficiënt
Log p = - 0,43
Dampdruk
5 mmHg bij 30 ºC.
Dissociatie constant
PKA = 11.72
pH
Waterstofperoxide -oplossingen zijn enigszins zuur. Een tot 35% heeft bijvoorbeeld een pH van 4,6; Maar bij het concentreren op 90%wordt de pH minder zuur: 5.1.
Brekingsindex (nD))
1.4061
Smurrie
1.245 cpoise bij 20 ° C.
Warmte capaciteit
1.267 J/G · K (gas)
2.619 J/G · K (vloeistof)
Verdampingswarmte
1.519 J/G · K
Stabiliteit
Stabiel onder de aanbevolen omstandigheden. De toevoeging van acetanylide en tinzouten stabiliseren het meer.
Corrosie
Corrosief
Ontleding
Het ontleedt door blootstelling aan licht of in aanwezigheid van oxiderende en vermindering van stoffen. Het wordt ook opgesplitst door opwarming. Wanneer het in beslag wordt genomen, worden water en zuurstof vrijgegeven en begunstigd door een toename van de pH en temperatuur, evenals met de aanwezigheid van het catlase -enzym.
Kan u van dienst zijn: natriumperoxide (NA2O2): structuur, eigenschappen, gebruikOppervlaktespanning
80.4 DIN/CM A 20 ºC
Reactiviteit
De H2OF2 Het fungeert als een oxidatiemiddel in zure oplossingen van ferro -ijzer (geloof2+) Ferrisch ijzer (f3+); Ook sulfietion oxideren (dus32-) tot sulfaat -ion (dus42-)).
Het kan ook fungeren als een reductiemiddel in aanwezigheid van basisoplossingen, waardoor de natriumhypochloriet (NaOCL) en kaliumpermanganaat worden verminderd (kmno4) Met zuurstofafgifte.
Toepassingen
Whitening
Waterstofperoxide wordt in de papieren industrie gebruikt bij het bleken van pulp en papier, wat het grootste deel van zijn jaarlijkse productie verbruikt.
Ontsmettingsmiddel
Waterstofperoxide is een zacht antisepticum om kleine wondinfectie, krassen en brandwonden te voorkomen. Het wordt ook gebruikt als een mondspoeling en om milde mondirritatie te verlichten vanwege de aanwezigheid van mondstukken of gingivitis.
Het wordt ook gebruikt om oppervlakken te desinfecteren, het interieur van koelkasten, water en het bestrijden van overmatige bacteriegroei in watersystemen en koeltorens. Waterstofperoxide brengt zuurstofvrije radicalen af, die verontreinigende stoffen ontleden.
Wasmiddel
Waterstofperoxide wordt gebruikt bij de productie van whiting wasmiddelen van de kleding, inclusief natriumcarbonaat. Deze verbinding is een complex van natriumcarbonaat en waterstofperoxide dat in het water wordt opgelost, scheidt in zijn componenten.
Cosmetische toepassing
Verdunde waterstofperoxide wordt gebruikt bij het bleken van haar, voorafgaand aan kleuring. Het wordt ook gebruikt om de tanden te bleken, als onderdeel van een zelfgemaakte tandheelkundige crème.
Drijfveer
Waterstofperoxide wordt gebruikt als een monoporpellant of oxiderende component van een bipropoone raket. Het breekt af met het vrijgeven van zuurstof en water, een kenmerk dat het gebruik ervan als drijfgas mogelijk maakte.
Een reactiecel wordt gepompt met de aanwezigheid van een katalysator die de ontleding versnelt. Tijdens dit wordt waterdamp bij hoge temperatuur geproduceerd.
Wanneer stoom door een opening wordt verdreven, produceert een impuls. De V-80-onderzeeër gebouwd in 1940, gebruikt in de zuurstofturbines gegenereerd uit waterstofperoxide; Walter turbinesysteem genoemd.
Het verkrijgen van
Aanvankelijk werd waterstofperoxide industrieel verkregen door hydrolyse van ammoniumpersulfaat, [(NH4))2S2OF8] of de elektrolyse van ammoniumbisulfaat, NH4HSO4.
Waterstofperoxide wordt industrieel verkregen door het gebruik van antraquinon. Het proces wordt uitgevoerd in vier fasen: hydrogenering, filtratie, oxidatie, extractie en zuivering.
Kan u bedienen: magnesiumfluoride: structuur, eigenschappen, synthese, gebruikHydrogenering
Alquilantroquinona wordt gehydrogeneerd door waterstofgas te passeren door een hydogenator geladen met aluminiumoxide en een kleine hoeveelheid katalysator (paladium). De temperatuur wordt gehouden op 45 ºC met permanente agitatie.
De alkyndrochinon wordt omgebouwd tot alquiloantrahydroquinona en het tetrahydroalquilantrahydroquinone, waardoor de laatste wordt geselecteerd voor het grootste gemak voor de volgende procedures.
Filtratie
De opgenomen oplossing.
Oxidatie
De gefilterde oplossing oxideert door lucht erdoorheen te gooien, waardoor waterstofperoxide met een lage zuiverheid worden gevormd.
Extractie en zuivering
De oplossing met waterstofperoxide kruist een extractiekolom met vloeistof-vloeistof. Water stroomt door de kolom, terwijl de oplossing met waterstofperoxide erdoor wordt gepompt.
Het water bereikt de bodem van de extractor met een concentratie waterstofperoxide tussen 25 en 35 % p/p. Vervolgens wordt het gezuiverd door vacuümdestillatie, tot een waterstofperoxideconcentratie van 30 %. Eindelijk gestabiliseerd en opgeslagen.
Risico's
 Waterstofperoxide verbrand. Bron: Bobjgalindo [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Waterstofperoxide verbrand. Bron: Bobjgalindo [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Waterstofperoxide is een corrosief middel, dus het huidcontact produceert ernstige irritatie, naast tijdelijke bleken (superieur beeld). Het kan ook oogschade, jeuk, salpt, roodheid en ampoules -vorming veroorzaken.
De inademing ervan produceert irritatie in de neus, keel en longen. Ondertussen kan herhaalde blootstelling bronchitis, hoest, slijm en ademhalingsverkorting veroorzaken. En alsof het niet genoeg was, genereert het ook hoofdpijn, vahid, misselijkheid en braken.
Ernstige blootstelling aan waterstofperoxide kan vloeibare accumulatie in de longen veroorzaken, wat bekend staat als een longoedeem: ernstige toestand die snel medische aandacht vereist.
De Occupational Safety and Health Administration (OSHA) heeft het maximale toegestane voor waterstofperoxide van 1 ppm in een werkomgeving in een dag van 8 uur vastgesteld. Omdat het echter een mutagene verbinding is, moet de blootstelling aan het minimum worden verminderd.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). Waterstof peroxide. Opgehaald uit: in.Wikipedia.borg
- William R. Busing en Henri a. Heffing. (2004). Kristal en moleculaire structuur van waterstofperoxide: een neutronen - diffractie -onderzoek. doen.org/10.1063/1.1696379
- Nationaal centrum voor biotechnologie -informatie. (2019). Waterstof peroxide. PubChem -database. CID = 784. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- De redacteuren van Enyclopaedia Britannica. (27 november 2018). Waterstof peroxide. Encyclopædia Britannica. Hersteld van: Britannica.com
- New Jersey Department of Health. (2016). Waterstof peroxide. [PDF]. Hersteld van: nj.Gov
- Mathews, c. K., Van Holde, K. EN., Ahern, K. G. (2002). Biochemie. Derde editie. Pearson Addison Wesley redactioneel
- MD Web. (2019). Waterstof peroxide. Opgehaald uit: WebMD.com
- « Azteekse geneeskunde geschiedenis, God, planten, ziekten
- Zinkoxide (ZnO) structuur, eigenschappen, gebruik, risico's »

