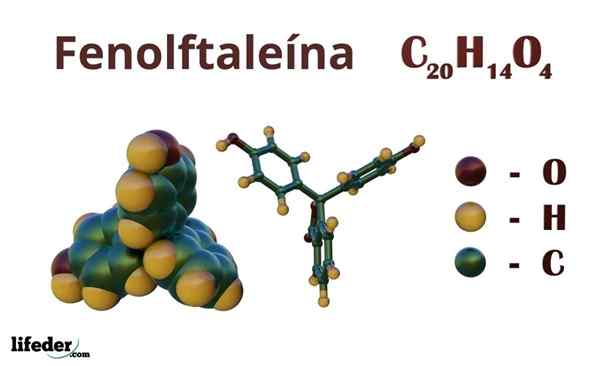
Fenolftaleïne (C20H14O4)
- 1220
- 0
- Nathan Wiegand
Wat is fenolftaleïne?
De fenolftaleïne Het is een organische kleurstof, die op zijn beurt een zwak diprotisch zuur is, gebruikt in vele volumetrische bepalingen als een zure bas-indicator. Dat wil zeggen, als het een diprotisch zuur is, kunt u in oplossing twee H -ionen verliezen+, En om een indicator te zijn, moet u de eigenschap hebben om kleurrijk te zijn in het pH -bereik dat wordt gewaardeerd.
In basismedium (pH> 8) is fenolftaleïne roze, dat kan worden geïntensiveerd tot een violet rood. Om te worden gebruikt als een zure base-indicator, moet u niet sneller reageren met OH- van de omgeving die analyseert om te bepalen.
Omdat het een zeer zwak zuur is, is de aanwezigheid van de groepen -COOH bovendien uitgesloten en daarom zijn de bron van zure protonen twee OH -groepen gekoppeld aan twee aromatische ringen.
Formule
Fenolftaleïne is een organische verbinding waarvan de gecondenseerde chemische formule c istwintigH14OF4. Hoewel misschien niet genoeg om te ontdekken welke organische groepen bezitten, kunt u uit de formule de onverzadiging berekenen, om uw skelet op te helderen.
Chemische structuur
 Structuur van fenolftaleïne
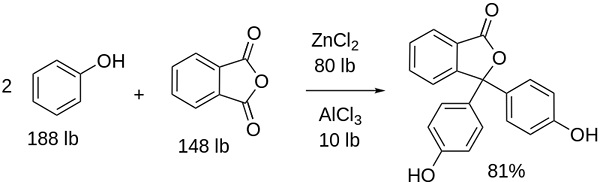
Structuur van fenolftaleïne De structuur van fenolftaleïne is dynamisch, wat betekent dat het veranderingen ondergaat, afhankelijk van de pH van zijn omgeving. In het superieure beeld wordt de structuur van fenolftaleïne in het bereik van 0 geïllustreerd Het is de vijfhoekige ring die de grootste wijzigingen lijdt. Bijvoorbeeld, in basismedium, wanneer een van de OH-groepen fenolische ringen, hun negatieve belasting (-o-) wordt aangetrokken door de aromatische ring, "openen" de vijfhoekige ring in de nieuwe opstelling van zijn links. Hier bevindt de nieuwe negatieve belasting zich in de groep -coo-, Die "eraf" uit de Pentagonal Ring kwam. Dan, na het verhogen van de basiciteit van het medium, is de tweede OH -groep van de fenolische ringen en de resulterende belasting verwoestend door de moleculaire structuur verslinden. Het inferieure beeld vat het resultaat samen van de twee niet -deprotonatie in basismedium. Deze structuur is verantwoordelijk voor de bekende roze kleuring van fenolftaleïne. De elektronen die "reizen" door het geconjugeerde π -systeem (weergegeven met de dubbele resonantiebindingen) absorberen in het zichtbare spectrum, met name in de golflengte van de gele kleur, die de roze kleur weerspiegelt die het oog van de aanstaande bereikt. Fenolftaleïne heeft in totaal vier structuren. De vorige twee zijn de belangrijkste in praktische termen en worden weergegeven afgekort als: H2In en in2-. Fenolftaleïne wordt gebruikt in chemische analyse als een visuele indicator bij het bepalen van het equivalentiepunt in neutralisatiereacties of zuurbasisgraden. Het reagens voor deze zuurbasisbeoordelingen wordt bereid bij 1 % opgelost in 90 % alcohol. Fenolftaleïne presenteert 4 staten: Dit gedrag heeft het gebruik van fenolftaleïne mogelijk gemaakt als een indicatie van de carbonatatie van beton, die de pH variëren tot een waarde tussen 8,5 en 9. Ook is de verandering in kleuring erg abrupt; dat wil zeggen het anion in2- Roze wordt met hoge snelheid geproduceerd. Bijgevolg kunt u hiermee een kandidaat zijn als indicator in veel volumetrische bepalingen; Bijvoorbeeld dat van een zwak zuur (azijnzuur) of sterk (zoutzuur). Fenolftaleïne werd gebruikt als laxatief middel. Er is echter een indicatieve wetenschappelijke literatuur dat sommige laxeermiddelen die fenolftaleïne bevatten als een actief principe - dat de absorptie van water en elektrolyten in de dikke darmbevorderende evacuaties remmen - negatieve effecten kunnen hebben - negatieve effecten kunnen hebben. Het langdurige gebruik van deze medicijnen die fenolftaleïne bevatten, wordt geassocieerd met de productie van verschillende aandoeningen in darmfunctioneren, pancreatitis en zelfs kanker, voornamelijk geproduceerd bij vrouwen en in de diermodellen die worden gebruikt voor de farmacologische studie van deze chemische verbinding. Chemisch gemodificeerd fenolftaleïne, en transformeer het vervolgens in zijn verminderde toestand, wordt gebruikt als een reagens in forensische tests die het mogelijk maken om de aanwezigheid van hemoglobine in een monster (Kastle-Meyer-test) te bepalen, die niet overtuigend is vanwege de aanwezigheid van valse positieven. Het wordt gevormd door de condensatie van het ftalische anhydride met het fenol, in aanwezigheid van geconcentreerd zwavelzuur en een mengsel van aluminium en zinkchloriden als katalysatoren van de reactie: Aromatische elektrofiele substitutie is het mechanisme dat deze reactie regelt. Waar bestaat het uit? De fenolische ring (het molecuul van links) is negatief geladen dankzij het zuurstofatoom dat rijk is aan elektronen, waardoor een gratis paar van hen "het elektronische circuit" van de ring kan laten reizen. Aan de andere kant, de koolstof van groep C = O van de ftalische anhydrid. De fenolische ring, rijk aan elektronen, valt deze slechte koolstof in elektronen aan, met de eerste ring in de structuur. Deze aanval vindt bij voorkeur plaats aan de andere kant van koolstof gekoppeld aan de OH -groep; Dit is de positie -voor. Hetzelfde geldt voor de tweede ring: het valt dezelfde koolstof aan en hieruit wordt een gegenereerde molecuul water vrijgegeven dankzij het zure medium. Op deze manier is fenolftaleïne niets meer dan een ftalisch anhydridemolecuul dat twee fenolische ringen in een van zijn carbonillus -groepen heeft opgenomen (C = O). Het fysieke uiterlijk is dat van een witte vaste stof met tricline -kristallen, vaak geagglomereerd of in de vorm van rhombische naalden. Het is toilet, dichter dan vloeibaar water (1.277 g/ml bij 32 ºC) en zeer weinig vluchtig (geschatte stoomdruk: 6,7 x 10-13 mmhg). Het is heel weinig oplosbaar in water (400 mg/l), maar zeer oplosbaar in alcoholen en ether. Om deze reden wordt het aanbevolen om het in ethanol te verdunnen voordat het wordt gebruikt. Het is onoplosbaar in aromatische oplosmiddelen zoals benzeen en tolueen, of in alifatische koolwaterstoffen zoals n-hexaan. Gevonden bij 262,5 ºC en de vloeistof heeft een kookpunt van 557,8 ± 50,0 ºC tot atmosferische druk. Deze waarden zijn indicatief voor sterke intermoleculaire interacties. Dit komt door waterstofbruggen, evenals de voor interacties tussen de ringen. De PKA is 9,7 tot 25 ºC. Dit vertaalt zich in een zeer lage trend om te dissociëren in waterig medium: H2In (AC) + 2H2Of (l) in2-(AC) + 2H3OF+ Dit is een waterige balans. De toename van OH -ionen- In de oplossing neemt de huidige hoeveelheid h af3OF+. Bijgevolg gaat het evenwicht naar rechts, om meer h te produceren3OF+. Op deze manier wordt het eerste verlies beloond. Naarmate meer basis wordt toegevoegd, blijft de balans naar rechts gaan, enzovoort totdat er niets van de soort is h2In. Op dit punt, de soort in2- Rosado kleur de oplossing. Ten slotte ontleedt fenolftaleïne bij het verwarmen, het uitzenden van een hectare en irritante rook.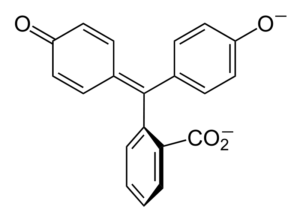
Gebruik/toepassingen van fenolftaleïne
 Alkalische oplossing toevoegen aan neutrale oplossing met fenolftaleïne -indicator
Alkalische oplossing toevoegen aan neutrale oplossing met fenolftaleïne -indicator Indicatorfunctie
Gebruik in de geneeskunde
Fenolftaleinsynthese
Fenolftaleïne eigenschappen
Referenties