P-nitrofenol-kenmerken, gebruik en toxiciteit
- 2405
- 19
- Dewey Powlowski
Hij P-nitrofenol of 4-nitrofenol is een fenolische organische verbinding, omdat het een benzeenring heeft bevestigd aan een hydroxylgroep. De letter "p" betekent "voor", en geeft aan dat de radicalen zich bevinden in positie 1 en 4 van de benzeenring.
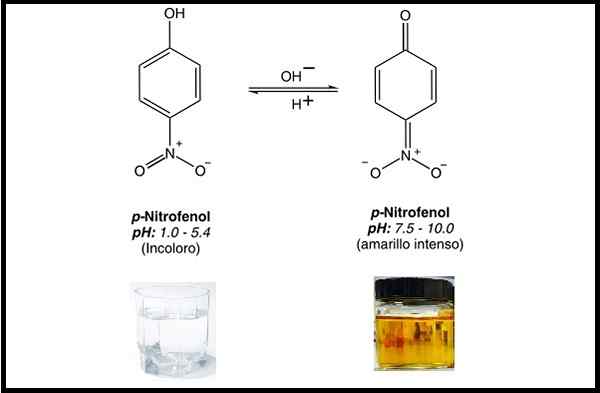
De aanwezige groepen zijn hydroxyl in positie 1 en groep nitro in positie 4. De chemische formule van de p-nitrofenol is c6H5NEE3. P-nitrofenol is een pH-indicator die kleurloos is tot pH onder 5,4 en geel is boven 7,5.
 Chemische structuur van p-nitrofenol bij zure pH en alkalische pH. Bron: Dannybalanta [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]/pxhere.com/Pexels.com. Bewerkte afbeelding
Chemische structuur van p-nitrofenol bij zure pH en alkalische pH. Bron: Dannybalanta [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]/pxhere.com/Pexels.com. Bewerkte afbeelding Aan de andere kant wordt deze verbinding gebruikt voor de synthese van verschillende stoffen van belang voor de gezondheid, zoals paracetamol (ook bekend als acetaminophen), een gerenommeerd analgeticum en antipyretisch.
Evenzo dient het als een voorloper om fenetidine te synthetiseren, wat een anticonvulsief is, en acetofenetidine, dat als analgeticum dient. Andere stoffen die kunnen voortkomen uit p-nitrofenol zijn verschillende grondstoffen die nodig zijn voor de productie van bepaalde fungiciden en pesticiden.
Afgezien hiervan is het ook grondstof voor de uitwerking van kleurstoffen, gebruikt om leer donkerder te maken.
Ondanks de voordelen is p-nitrofenol echter een stof die zeer voorzichtig moet zijn, omdat het een hoog risico op gezondheid heeft. Het heeft een lichte ontvlambaarheid en matige reactiviteit, zoals aangegeven door de NFPA (National Fire Protection Association).
[TOC]
Kenmerken
P-nitrofenol is een synthetische chemische stof, dat wil zeggen dat het niet komt uit natuurlijke bronnen.
Het wordt gekenmerkt door een wit-gele of geel kristallijn poeder te zijn. De p-nitrofenol heeft een moleculaire massa van 139,11 g/mol, een kookpunt van 279 ° C, een fusiepunt van 110-115 ° C en een zelfsturingstemperatuur van 268 ° C. Deze stof verdampt niet bij kamertemperatuur.
Wateroplosbaarheid bij kamertemperatuur is 16 g/l. Het is oplosbaar in ethanol, chloroform en diethylter.
P-nitrofenol is een complexe verbinding, omdat de vaste toestand (kristallen) wordt gevormd door een mengsel van twee moleculaire vormen: een zogenaamde alfa en een andere bèta.
Het kan u van dienst zijn: ficologieIn de alpha-vorm (4-nitrofenol) is het kleurloos, het presenteert instabiliteit bij kamertemperatuur en vertoont geen veranderingen in zonlicht (stabiel).
Terwijl de bèta-vorm (4-nitrofenolaat of fenoxide) wordt gepresenteerd als gele kristallen en gedraagt zich tegengesteld; dat wil zeggen, het is stabiel bij kamertemperatuur, maar in het gezicht van zonlicht wordt het geleidelijk rode kleur.
Deze stof presenteert zijn isosbetische punt bij 348 nm voor alfa- en bèta -vorm.
Toepassingen
PH -indicator
Hoewel deze verbinding een pH -indicatorfunctie heeft, wordt deze niet veel gebruikt voor dit doel. Met betrekking tot kleurveranderingen volgens de pH heeft het veel gelijkenis met andere pH -indicatoren zoals timophtaleïne en fenolftaleïne. Ze hebben gemeen dat ze kleurloos zijn bij lage pH.
Voorloper in de synthese van verbindingen
P-nitrofenol is een verbinding die in de farmaceutische industrie wordt gebruikt om stoffen te synthetiseren met gunstige gezondheidseffecten.
Van p-nitrofenol kan bijvoorbeeld acetaminophen of paracetamol worden gesynthetiseerd, wat een van de geneesmiddelen is met analgetische en antipyretische werking die meer door de gemeenschap in het algemeen wordt gebruikt.
Het leidt ook fenetidine af, een anticonvulsiva dat wordt gebruikt in gevallen van CNS -aandoeningen. Evenals acetofenetidine met analgetische actie.
P-nitrofenol-vorming van de werking van bepaalde enzymen op specifieke substraten
4-nitrofenylfosfaat is een synthetisch substraat dat wordt gebruikt voor alkalische fosfatase. Wanneer het enzym op dit substraat werkt, vormt p-nitrofenol (kleurloze substantie).
Vervolgens verliest de 4-nitrofenol protonen om 4-nitrofenolaat te worden, dat geel is. De reactie moet worden gegeven op alkalische pH> 9.0 om de omzetting naar de bèta-vorm (4-nitrofenolaat) te bevorderen.
De gegenereerde kleur wordt spectrofotometrisch gemeten bij 405 nm, en dus kan dit enzym worden gekwantificeerd.
Kan u van dienst zijn: relatie tussen aanpassing en differentiële overleving van levende wezensHetzelfde gebeurt voor andere enzymen over andere substraten. Onder hen kunnen we de werking van het carbonische anhydrase-enzym op 4-nitrofenyl en glycosidase-acetaat vermelden over 4-nitrofenyl-β-D-glucopyranoside.
Toxiciteit
Volgens de NFPA (National Fire Protection Association) wordt p-nitrofenol gecatalogiseerd als een stof met gezondheidsrisico 3. Dit betekent dat de schade aan de gezondheid ernstig is.
Aan de andere kant heeft het een risico op ontvlambaarheid van 1, wat betekent dat het risico op vuur mild is. Ten slotte heeft het een risico op reactiviteitsgraad 2 (matig risico). Dit betekent dat deze stof onder bepaalde omstandigheden energie kan uitzenden.
Gezondheidseffecten
Een van de meest prominente effecten die door deze stof op de gezondheid worden gepresenteerd, zijn degenen die we hieronder zullen vermelden.
Op huidniveau produceert irritatie, ontsteking en verbranding. Bovendien vertegenwoordigt het huidcontact een productabsorptieroute. Een overdreven blootstelling aan p-nitrofenol kan het centrale zenuwstelsel (CNS) beïnvloeden.
Op het oculaire slijmvlies kan het ernstige verbranding veroorzaken, met ernstige oculaire schade. Op ontsteking, hoest en verstikking op ademhalingsniveau. In het geval van accidentele inname produceert braken met sterke buikpijn, mentale verwarring, tachycardie, koorts en zwakte.
Als het in grote hoeveelheden wordt geabsorbeerd, kan het een ziekte veroorzaken die methemoglobinemie worden genoemd, gekenmerkt door een toename van de hoeveelheid bloedmethemoglobine.
Deze ziekte beïnvloedt het zuurstoftransport aanzienlijk en genereert daarom een symptomatologie die wordt gekenmerkt door hoofdpijn, vermoeidheid, duizeligheid, cyanose en ademhalingskast. In ernstige gevallen kan het ook de dood veroorzaken.
Mensen die worden blootgesteld aan kleine hoeveelheden zullen het product door urine elimineren. Ten slotte is, ondanks alle beschreven schadelijke effecten, niet bewezen dat het een carcinogeen effect heeft.
E.H.B.O
Als u in contact bent gekomen met het product, is het noodzakelijk om vervuilde kleding te verwijderen en het getroffen gebied (huid of slijmvlies) te wassen met veel water. Breng het slachtoffer in het geval van inademing naar een luchtige plaats. In het geval dat de patiënt niet ademt, brengt u geassisteerde ademhaling aan.
Kan u van dienst zijn: welke soorten bloedcirculatie bestaan er?Hierna is het noodzakelijk om het slachtoffer zo snel mogelijk over te dragen naar een medisch zorgcentrum.
Bioveiligheidsmaatregelen
- U moet werken onder dampextractiebel, of anderszins ademhalings-. Gebruik goede kleding (jurk, handschoenen, veiligheidslenzen, gesloten schoenen en hoed).
- Was de kleding onmiddellijk vervuild met het product.
- Breng geen besmet werkwerktuigen bij u thuis mee.
- De werkplek moet worden begiftigd met het witwassen en nooddouches.
- Hoewel deze stof wordt gemanipuleerd, draag je geen contactlenzen.
- Rook, eet of drink niet in de faciliteiten waar deze stof wordt gemanipuleerd.
- Houd er rekening mee dat p-nitrofenol onverenigbaar is met bepaalde stoffen, en daarom moet het afzonderlijk worden opgeslagen van sterke alkaliërs, zoals natriumhydroxide of kaliumhydroxide. Het is ook onverenigbaar met peroxiden, perchloraat, permanganatos, chloor, nitraten, chlorines, broom en fluor, onder andere oxidatiemiddelen.
- Houd er rekening mee dat in het geval van vuur de containers die deze stof bevatten kunnen exploiteren.
Referenties
- New Jersey Department of Health and Senior Services. Informatieblad over gevaarlijke stoffen. 4-nitrofenol. 2004. Beschikbaar op: NJ.Gov/Health.
- “4-nitrofenol." Wikipedia, gratis encyclopedie. 22 februari 2019, 13:58 UTC. 29 mei 2019, 03:59 Wikipedia.borg.
- Rojas H, Cubillos J, Guerrero D. P-nitrofenol hydrogenering door het gebruik van IR, en IR-NI-katalysatoren ondersteund in TiO2. Faculteit van engineering, UPTC; 2012, 21 (3): 63-72
- Agentschappen voor giftige stoffen en ziektecord. Samenvattingen voor de volksgezondheid. Nitrofenolen. Beschikbaar op: ATSDR.CDC.Gov
- Nationaal Instituut voor veiligheid en hygiëne op het werk. Internationale chemische beveiligingsbladen. 4-nitrofenol. Spanje. Beschikbaar op: Insht.Het is/inshtweb
- « 12 pre -Hispanic Meals en hun ingrediënten
- 14 tekenen dat je intelligent bent en je hebt zelfbeheersing »

