Gedegenereerde orbitalen
- 4316
- 473
- Lonnie Rohan
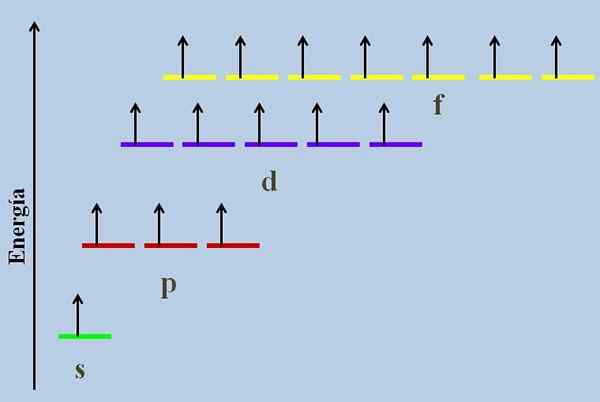
 Energieschema met de orbitalen bezet door ontbrekende elektronen. Bron: Gabriel Bolívar
Energieschema met de orbitalen bezet door ontbrekende elektronen. Bron: Gabriel Bolívar De Gedegenereerde orbitalen Ze zijn die gevonden op hetzelfde energieniveau. Volgens deze definitie moeten ze hetzelfde belangrijkste kwantumnummer hebben N. Aldus worden 2S- en 2p -orbitalen gedegenereerd, omdat ze tot energieniveau 2 behoren, hoewel het bekend is dat hun functies van hoekige en radiale golven verschillend zijn.
Als de waarden van N, Elektronen beginnen andere subsubs van energiesubs te bezetten, zoals D en F -orbitalen.
Elk van deze orbitalen heeft hun eigen kenmerken, die op het eerste gezicht worden waargenomen in hun hoekvormen; Dit zijn de sferische figuren (en), van halters (P), van klaverbladeren (D) en bolvormige (F).
Onder hen is er een energieverschil, zelfs behorend tot hetzelfde niveau N.
Een energieschema met de orbitalen bezet door ontbrekende elektronen (een abnormaal geval) wordt bijvoorbeeld weergegeven in de bovenste afbeelding (een abnormaal geval).
Het is te zien dat van alles de meest stabiele (de minste energie) de ns orbital (1s, 2s, ...) is, terwijl de NF het meest onstabiel is (die met de grootste energie).
Gedegenereerde orbitalen van een geïsoleerd atoom
Gedegenereerde orbitalen, met dezelfde waarde als N, Ze staan in dezelfde lijn in een energieschema.
Om deze reden bevinden de drie rode strepen die de orbitalen P staan, zich in dezelfde lijn; Zoals op dezelfde manier de paarse en gele strepen doen.
Het beeldschema schendt de zinkregel: de orbitalen van grotere energie zijn gevuld met elektronen.
Kan u van dienst zijn: zuren en basen: verschillen, kenmerken, voorbeeldenWanneer de elektronen paren, verliest de orbitale energie en oefent een grotere elektrostatische afstoting uit op de ontbrekende elektronen van de andere orbitalen.
Dergelijke effecten worden echter niet in veel energiediagrammen beschouwd. Als dat zo is, en de zinkregel gehoorzamen zonder de orbitalen D volledig te vullen, zou worden gezien dat ze ophouden te worden gedegenereerd.
Zoals hierboven vermeld, heeft elk orbitaal zijn eigen kenmerken. Een geïsoleerd atoom, met zijn elektronische configuratie, bereidt zijn elektronen in het precieze aantal orbitalen waarmee ze ze kunnen hosten.
Alleen degenen in energie kunnen als gedegenereerd worden beschouwd.
Orbitalen P
De drie rode strepen voor de orbitalen van het beeld van de afbeelding geven aan dat beide pX, PEn En PZ Ze hebben dezelfde energie.
Er is een elektron verdwenen in elk, beschreven door vier kwantumnummers (N, l, ml En Mevr), terwijl de eerste drie de orbitalen beschrijven.
Het enige verschil tussen hen wordt aangeduid met het magnetische moment ml, die het traject van P trektX Op een x -as, pEn op de y -as en pZ Op de Z -as.
De drie zijn hetzelfde, maar ze verschillen alleen in hun ruimtelijke oriëntaties. Om deze reden worden ze altijd in energie getrokken, dat wil zeggen gedegenereerd.
Net als hetzelfde, een onomotief stikstofatoom (met 1s configuratie22s22 p3) U moet uw drie orbitalen gedegenereerd houden. Het energiescenario verandert echter abrupt als het wordt beschouwd als een atoom van N binnen een chemisch molecuul of verbinding.
Het is zo omdat hoewel pX, PEn En PZ Ze zijn hetzelfde in energie, dit kan in elk van hen variëren als ze verschillende chemische omgevingen hebben; dat wil zeggen, als ze gekoppeld zijn aan verschillende atomen.
Kan u van dienst zijn: isopreno: structuur, eigenschappen, toepassingenOrbitalen D
De vijf paarse strepen geven de orbitalen aan D aan. In een geïsoleerd atoom, zelfs als ze gekoppelde elektronen hebben, worden ze geacht dat deze vijf orbitalen worden gedegenereerd. In tegenstelling tot de P -orbitalen is er deze keer echter een duidelijk verschil in hun hoekvormen.
Daarom reizen hun elektronen aanwijzingen in de ruimte die variëren van de ene orbitale D tot de andere.
Dit veroorzaakt volgens de Kristallijne veldtheorie, dat een minimale verstoring een Energie die zich ontvouwt van de orbitalen; Dat wil zeggen, de vijf paarse strepen scheiden zich achter die een energiekloof tussen hen achterlaten:
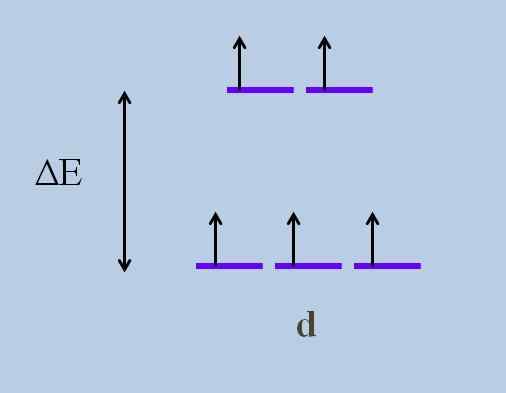 Energie -ontplooiende schema van orbitalen. Bron: Gabriel Bolívar
Energie -ontplooiende schema van orbitalen. Bron: Gabriel Bolívar Wat zijn de hierboven de orbitalen en welke zijn die hieronder? Die hierboven worden gesymboliseerd als EnG, en die hieronder T2 g.
Merk op hoe aanvankelijk alle paarse strepen werden uitgelijnd, en nu werd een set van twee orbitalen gevormd EnG Meer energie dan de andere set van drie orbitalen T2 g.
Deze theorie maakt het mogelijk om de D-D-overgangen uit te leggen, waaraan veel van de kleuren die worden waargenomen in de verbindingen van de overgangsmetalen (Cr, Mn, Faith, enz.)).
Deze elektronische verstoring is te wijten aan de coördinatie -interacties van het metaalcentrum met andere moleculen genoemd Liganden.
Orbitalen f
En met de orbitalen F, de zeven gele strepen, is de situatie verder ingewikkeld. De ruimtelijke adressen variëren sterk tussen hen, en de visualisatie van hun links wordt te complex.
In feite wordt geacht dat orbitalen F van zo'n interne laag zijn dat ze "niet waardend deelnemen" in de vorming van links.
Het kan u van dienst zijn: perchlooroxide (CL2O7)Wanneer het atoom geïsoleerd met orbitalen F wordt omgeven door andere atomen, treedt interacties aan en vindt het zich af (verlies van degeneratie):
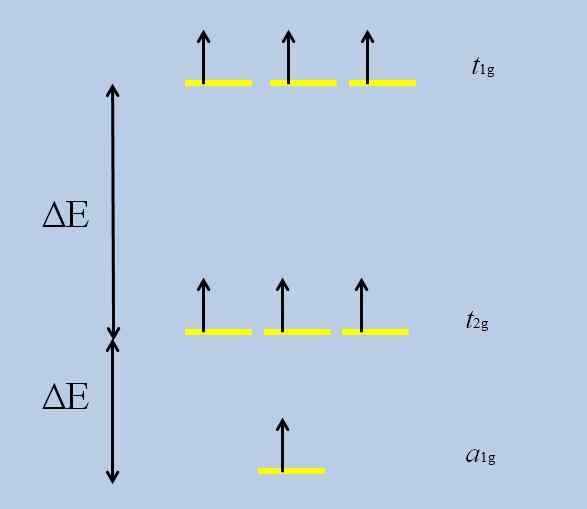 Schema van degeneratieverlies. Bron: Gabriel Bolívar
Schema van degeneratieverlies. Bron: Gabriel Bolívar Merk op dat nu de gele strepen drie sets vormen: T1 g, T2 g En naar1 g, En ze worden niet langer gedegenereerd.
Gedegenereerde hybride orbitalen
Er is gezien dat orbitalen zich kunnen ontvouwen en degeneratie verliezen. Hoewel dit elektronische overgangen verklaart, verduidelijkt het echter niet hoe en waarom er verschillende moleculaire geometrieën zijn. Hier komen de hybride orbitalen binnen.
Het belangrijkste kenmerk is dat ze gedegenereerd zijn. Daarom komen ze voort uit het mengsel van orbitale karakters s, p, d en f, om gedegenereerde hybriden te veroorzaken.
Drie P -orbitalen worden bijvoorbeeld gemengd met één S om vier SP -orbitalen te geven3. Alle sp orbitalen3 Ze worden gedegenereerd en hebben daarom dezelfde energie.
Als bovendien twee orbitalen worden gemengd met de vier SP3, Er worden zes orbitalen verkregen3D2.
En hoe verklaren moleculaire geometrieën? Omdat er zes zijn, met gelijke energieën, moeten ze bijgevolg symmetrisch worden geleid in de ruimte om gelijke chemische omgevingen te genereren (bijvoorbeeld in een MF -verbinding6)).
Wanneer ze dat doen, wordt een octaëder van coördinatie gevormd, die gelijk is aan een octaëdrische geometrie rond een centrum (M).
Geometrieën vertonen echter meestal vervormingen, wat betekent dat zelfs hybride orbitalen niet volledig worden gedegenereerd.
Daarom bestaan gedegenereerde orbitalen daarom alleen in geïsoleerde atomen of zeer symmetrische omgevingen.
Referenties
- Definitie van Degerate. Hersteld van: chemicool.com
- Atomen en atomaire orbitalen. Hersteld van Sparknotes.com
- Whitten, Davis, Peck & Stanley. Scheikunde. (8.ª ED.)). Cengage leren.

