Nucleofiele nucleofiele aanval, typen, voorbeelden, nucleofiliciteit
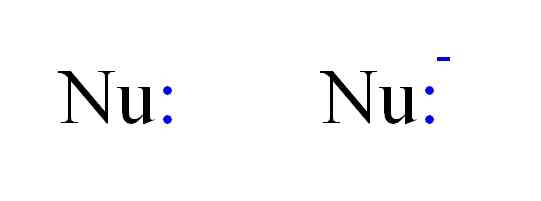
- 3678
- 726
- James Dach
A nucleofiel Het is allemaal atoom, ion of molecuul dat paren elektronen wil doneren aan stoffen met positieve belastingen of regio's. Het woord betekent 'liefde voor de kernen'. Wanneer een atoom of een moleculair gebied slecht is in elektronen, ervaart het een kracht van een grotere aantrekkingskracht door de atoomkernen; En precies, deze attractie trekt nucleofielen aan.
Daarom, zoals tegengestelde tekenen worden aangetrokken, moeten nucleofielen negatieve soorten zijn; of tenminste, het bezit van zeer negatieve gebieden vanwege een lokale of verspreide elektronenconcentratie.
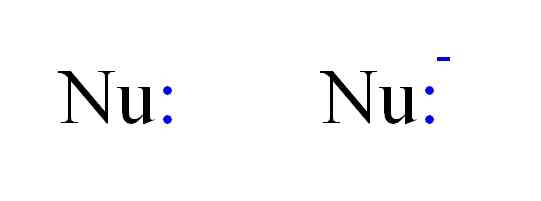 De twee meest voorkomende soorten nucleofielen in de chemie. Bron: Gabriel Bolívar.
De twee meest voorkomende soorten nucleofielen in de chemie. Bron: Gabriel Bolívar. Aldus kan een nucleofiel worden weergegeven door de Nu letters, zoals in de afbeelding hierboven. De dubbele punten in blauw komen overeen met een paar elektronen, die doneren aan de elektrofiel; Dit is het atoom of slechte elektronenmolecuul. Merk op dat de nucleofiel neutraal of anionisch kan zijn, maar beide doneren elektronenparen.
De aanval van nucleofielen op elektrofielen is de hoeksteen van talloze reacties en organische mechanismen. Een voorbeeld van nucleofiel is hydroxylanion, oh-, Dat gedraagt zich ook als basis. Nucleofiliciteit mag echter nooit worden verward met de basiciteit van een stof.
[TOC]
Nucleofiele aanval
Nucleofielen kijken. De volgende chemische vergelijking vertegenwoordigt de nucleofiele aanval:
Wildebeest: + R-LG → R-nu + LG:
De nucleofiel nu: doneert zijn paar elektronen A R, dat is gekoppeld aan een elektronegatieve LG -groep. Daarbij is de R-LG-link verbroken, LG's Emigra:, en de nieuwe R-NU-link wordt gevormd. Dit is de basis voor veel organische reacties.
In de volgende sectie zal worden gezien dat een nucleofiel zelfs een aromatische ring kan zijn, waarvan de elektronische dichtheid in zijn centrum wordt verspreid. Evenzo kan een nucleofiel een sigma -binding worden, wat betekent dat de elektronen van hetzelfde emigreren of in de nabijgelegen kernen springen.
Kan u van dienst zijn: kaliumchromaat (k2cro4)Soorten nucleofielen
Er zijn verschillende soorten nucleofielen, maar de overgrote grote.
Soorten met vrije elektronenparen
Wanneer we het hebben over soorten met vrije elektronenparen, verwijzen we naar anionen of moleculen met elektronegatieve atomen, zoals zuurstof, stikstof en zwavel. In de voorbeelden sectie zullen veel nucleofielen van dit type worden gezien, afgezien van Anion OH- al genoemd.
Dubbele links
Een nucleofiel kan dubbele bindingen hebben, die verantwoordelijk zijn voor de nucleofiele aanval. Ze moeten echter dubbele bindingen zijn met een aanzienlijke elektronische dichtheid, dus geen molecuul dat ze bezit, zal als een sterke nucleofiel worden beschouwd; dat wil zeggen, het zal geen hoge nucleofiliciteit hebben.
Overweeg bijvoorbeeld de benzeenring bij de volgende reactie van alkylering (Friedel-Crafts-reactie):
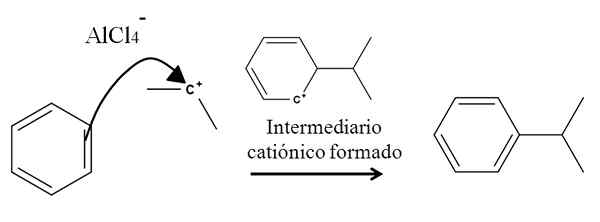 Benzeenalkylering bij aromatische elektrofiele substitutie. Bron: Gabriel Bolívar.
Benzeenalkylering bij aromatische elektrofiele substitutie. Bron: Gabriel Bolívar. De aanwezigheid van een ALCL -mengsel3-(Ch3))2CHCL ontstaat isopropylcarbocatie. De positieve belasting en instabiliteit trekt de elektronen sterk aan van een van de dubbele bindingen van de benzeen, die carbocatie aanvallen, zoals vertegenwoordigd door de pijl.
In het proces wordt een kort kationisch en aromatisch intermadiary gevormd, dat uiteindelijk wordt omgezet in het juiste product.
Evenals bij benzeen kunnen andere stoffen met dubbele bindingen als nucleofielen werken, op voorwaarde dat de reactieomstandigheden het meest geschikt zijn. Evenzo moeten er atomen zijn in de buurt van de dubbele binding die elektronische dichtheid doneren, zodat ze "opladen" van elektronen.
Sigmas -links
Sigma -bindingen als zodanig zijn geen nucleofielen; Maar het kan zich als zodanig gedragen zodra een reactie begint en het mechanisme begint. Overweeg het volgende voorbeeld:
Het kan u van dienst zijn: Linding Salts: wat zijn, nomenclatuur, eigenschappen, voorbeelden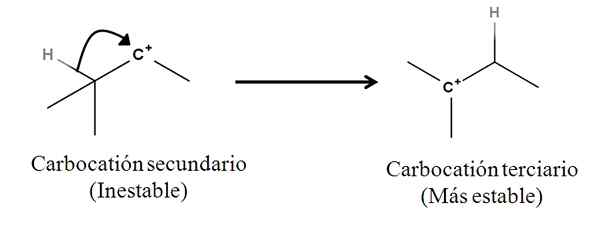 Conversie van een secundaire naar tertiaire carbocatie door migratie van een hydride -anion. Bron: Gabriel Bolívar.
Conversie van een secundaire naar tertiaire carbocatie door migratie van een hydride -anion. Bron: Gabriel Bolívar. De Sigma C-H-binding grenzend aan carbocatie beweegt zich naar hem toe die zich gedraagt als een nucleofiel (zie beweging van de gebogen pijl). In die zin is het resultaat dat anion h beweegt- aan de aangrenzende koolstof, maar zo snel dat de Sigma -binding en zijn paar elektronen als het nucleofiele middel van dit mechanisme wordt beschouwd.
Nucleofiele voorbeelden
Deze sectie zal verschillende voorbeelden vermelden van het eerste type nucleofielen, die zeer overvloedig en belangrijk zijn in organische en anorganische chemie.
Halogenuros
Halogenuros (f-, Klet-, BR- en ik-) Het zijn nucleofielen. Moet een van hun vier paar valentie -elektronen doneren. Afhankelijk van de snelheid waarmee een van deze halogenuros de elektrofie aanvalt, zal een grotere of mindere nucleofiliciteit hebben.
Over het algemeen, de i- Het is een betere nucleofiel dan f- en de andere halogenuros, omdat het gemakkelijker is om een covalente link te vormen omdat het meer polariseerbaar is; Dat wil zeggen, meer omvangrijk en met minder vasthoudendheid om zijn paar elektronen op te geven.
Elektronegatieve atoommoleculen
 Watermoleculen
Watermoleculen Water, HAH, is een nucleofiel, omdat zuurstofatoom een hoge negatieve dichtheid heeft en vrije elektronenparen om een covalente binding te doneren en te vormen. Ook zijn alcoholen, ROH, nucleofielen, om dezelfde redenen als die van water.
Kleine stikstofmoleculen zoals ammoniak, NH3, Ze zijn ook meestal nucleofielen. Dit komt omdat stikstof zijn solitaire paar elektronen kan doneren. Evenzo, amines, rnh2, Het zijn ook nucleofielen.
En naast kleine moleculen met zuurstof of stikstof, tellen zwavels ook als nucleofielen. Dit is het geval van waterstofsulfide, h2S, en de thiolen, rsh.
Zwavel is een betere nucleofiel dan zuurstof en stikstof omdat het minder "vastklampt" aan zijn paar elektronen, dus het is gemakkelijker om het te doneren. Hieraan moet ook worden toegevoegd dat het atoom meer volumineuze is, dat wil zeggen, meer polariseerbaar en daarom in staat zijn om covalente bindingen te vormen met minder moeilijkheid.
Het kan u van dienst zijn: Mohr -methode: fundamentals, reacties, procedure, gebruikAnionen
Geoxygeneerde, stikstof, gesulfuriseerde anionen, en in het algemeen zijn verschillende van hen sterke nucleofielen. Dit komt omdat ze nu een negatieve belasting hebben die de aanwezigheid van het paar elektronen dat ze zullen doneren verder intensiveert.
Overweeg bijvoorbeeld de volgende anionen die in de afnemende volgorde van nucleofiliciteit worden geplaatst:
: Ch3- >: NH2- >: Oh- >: F-
Het carboanion ch3- Het is de sterkste nucleofiel omdat het koolstofatoom de negatieve belasting niet stabiliseert, waarvan de elektronen "wanhopig" zijn door de nabijgelegen kernen. Dit gebeurt niet met de amiduro, NH2-, wiens stikstofatoom de negatieve belasting beter stabiliseert en het paar elektronen gemakkelijker oplevert dan de OH- of f-.
Nucleofiliciteit
Nucleofiliciteit definieert hoe sterk het nucleofiele karakter van een soort is. Dit hangt af van vele factoren, maar de belangrijkste is de sterische belemmering tijdens de nucleofiele aanval en de werking van de oplosmiddel.
Hoe kleiner de nucleofiel, hoe sneller en effectief het is uw elektrofiele aanval. Ook hoeveel de interacties tussen het oplosmiddel en de nucleofiel verlagen. Daarom, volgens dit, de i- heeft meer nucleofiliciteit dan f-.
Referenties
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5e editie. Redactionele addison-wesley inter-Amerikaan.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e editie.)). Wiley Plus.
- James Ashenhurst. (2020). De drie klassen van nucleofielen. Hersteld van: MasterGanicChemistry.com
- Professor Patricia Shaley. (2012). Nucleofielen en elektrofielen. Universiteit van Illinois. Hersteld van: Butane.Chem.Uiuc.Edu
- Wikipedia. (2020). Nucleofiel. Opgehaald uit: in.Wikipedia.borg
- Helmestine, Anne Marie, pH.D. (11 februari 2020). Nucleofiele definitie in de chemie. Hersteld van: Thoughtco.com
- Rachael Curtis. (5 juni 2019). Nucleofiel. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- « Thermodynamische systeemeigenschappen, typen, voorbeelden
- EXBIDISCHE VERTELLINGEN Concept, kenmerken en voorbeelden »

