Nitrobenzeen (C6H5NO2) structuur, eigenschappen, gebruik, risico's

- 695
- 135
- Kurt Aufderhar Jr.
Hij nitrobenzeen Het is een aromatische organische verbinding gevormd door een benzenische ring C6H5- En een nitro -geen groep2. De chemische formule is c6H5NEE2. Het is een kleurrijke of lichtgele olieachtige vloeistof, met een geur van bittere amandelen of schoenen voor schoenen.
Nitobenzeen is een zeer nuttige verbinding in de chemische industrie omdat het mogelijk een reeks chemische stoffen kan verkrijgen die gevarieerd worden gebruikt. Dit komt omdat het kan worden onderworpen aan verschillende soorten reacties.
 Nitrobenceen, c6H5-NEE2. Auteur: Marilú Stea.
Nitrobenceen, c6H5-NEE2. Auteur: Marilú Stea. Een van de belangrijke chemische reacties zijn nitratie (waarmee u meer groepen kunt toevoegen -niet2 naar het molecuul) en de reductie (het tegenovergestelde van oxidatie als de twee zuurstofatomen van de nitrogroep -nee worden geëlimineerd2 en worden vervangen door hydrogenen).
Met nitrobenceen kunt u zich voorbereiden bijvoorbeeld aniline en para-acetaminophenol. De laatste is de goed bekende acetaminophen die een antipyretische (koortsmedicatie) en zacht analgetic is (minderjarige pijnmedicijn).
Nitobenzeen moet met voorzichtigheid worden gemanipuleerd omdat het irritant en giftig is, het kan een soort bloedarmoede veroorzaken, tussen verschillende symptomen, en er wordt aangenomen dat het kanker kan veroorzaken. Het is ook schadelijk voor het milieu.
[TOC]
Structuur
De nitrobenzeen c6H5-NEE2 Het is een plat molecuul gevormd door een benzenische ring c6H5- waaraan een nitro -groep is gekoppeld2. Het molecuul is plat omdat er een elektronische interactie is tussen de nitro -geen groep2 en de benzeenring.
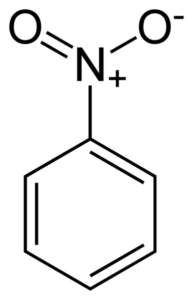 Vlakke structuur van het nitrobenzeenmolecuul. De elektronen van de Double Bondyan -ringverbindingen hebben de neiging om te interageren met de nitro -geen groep2. Auteur: Benjah-BMM27. Bron: Wikimedia Commons.
Vlakke structuur van het nitrobenzeenmolecuul. De elektronen van de Double Bondyan -ringverbindingen hebben de neiging om te interageren met de nitro -geen groep2. Auteur: Benjah-BMM27. Bron: Wikimedia Commons. De nitro -geen groep2 heeft de neiging de elektronen van de benzene ring C aan te trekken6H5-.
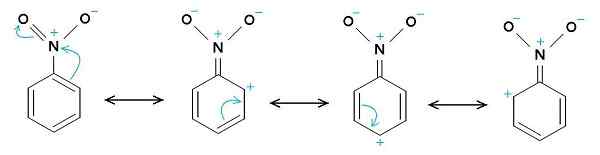 Nitrobenzeen resonantie structuren. De benzeenring heeft de neiging om een positieve belasting te hebben, terwijl de Nitro -NO2 -groep de neiging heeft om een negatieve belasting te hebben. De originele uploader was Samuele Madini bij Italiaanse Wikipedia. [Publiek domein]. Bron: Wikimedia Commons.
Nitrobenzeen resonantie structuren. De benzeenring heeft de neiging om een positieve belasting te hebben, terwijl de Nitro -NO2 -groep de neiging heeft om een negatieve belasting te hebben. De originele uploader was Samuele Madini bij Italiaanse Wikipedia. [Publiek domein]. Bron: Wikimedia Commons. Dat is de reden waarom het molecuul een iets meer negatieve kant heeft (waar de zuurstof van -no is2) en een iets meer positieve kant (de benzeenring).
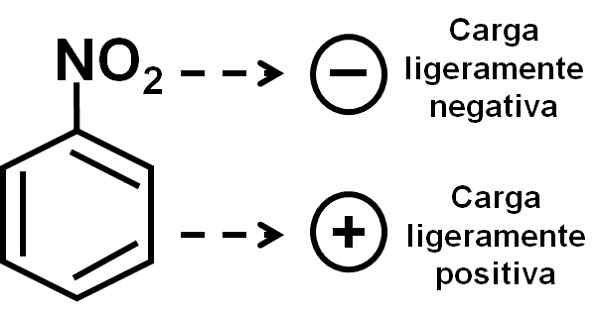 De zuurstof van de nitrogroep heeft een licht negatieve belasting in vergelijking met de benzene ring. Auteur: Marilú Stea.
De zuurstof van de nitrogroep heeft een licht negatieve belasting in vergelijking met de benzene ring. Auteur: Marilú Stea. Nomenclatuur
- Nitrobenzeen.
- Nitrobenze.
- Nitrobenzol.
- Olie of essentie van Mirbano of Mirbana (niet meer gebruikte termijn).
Eigenschappen
Fysieke staat
Kleurrijke olieachtige vloeistof tot lichtgeel.
Molecuulgewicht
123.11 g/mol.
Smeltpunt
5.7 ºC.
Kookpunt
211 ºC.
Het kan u van dienst zijn: Cobalt -chloride (COCL2 (: Structuur, Nomenclatuur, EigenschappenFlitslicht
88 ºC (methode gesloten beker).
Zelf -richtingtemperatuur
480 ° C.
Dikte
1.2037 g/cm3 bij 20 ºC.
Oplosbaarheid
Little water oplosbaar: 0,19 g/100 g water bij 20 ° C. Volledig mengbaar met alcohol, benzeen en Dietyl Ether.
Chemische eigenschappen
Nitrobenceen is stabiel tot ongeveer 450 ° C temperatuur waarin het begint te ontleden (in afwezigheid van zuurstof) nee, nee2, benzeen, bifenyl, aniline, dibenzofurano en naftaleen.
Een van de belangrijke reacties van nitrobenceen zijn reductie, nitratie, halogenering en sulfonering.
Nitrobenzeennitratie produceert aanvankelijk meta-nitrobenzeen en met een lange tijd van reactie wordt 1,3,5-nitobenzeen verkregen.
Reageren van bromine of chloor met nitrobenzeen in aanwezigheid van een geschikte katalysator wordt verkregen 3-broom-nitrobenzeen (meta-bromonitrobenceen) of 3-cllor-nitrobenzeen (meta-chloritrobenzeen).
Een voorbeeld van reductie is dat bij het omgaan met tin (SN) in zoutzuur (HCl) de meta-halogenonitobenzenen worden verkregen door de meta-halogenoanylines.
De sulfonering van nitrobenzeen wordt uitgevoerd met rokende zwavelzuur bij 70-80 ° C en het product is meta-nitrobenzeulfonische meta-nitrobenze. Dit kan worden verminderd met ijzer en HCl om methanylzuur te geven.
Dimmervorming
In een benzeenoplossing c6H6 Nitrobenceenmoleculen worden geassocieerd met elkaars vormende diameter of moleculenparen. In deze paren bevindt een van de moleculen zich in een omgekeerde positie ten opzichte van de andere.
De vorming van nitrobenzeendiameters met moleculen één in een omgekeerde positie ten opzichte van de andere is mogelijk te wijten aan het feit dat elk van hen een iets positievere kant heeft en een tegenovergestelde zijde met iets meer negatieve belasting.
In de dimeer bevindt de zijkant met iets meer positieve belasting van een van de moleculen mogelijk dicht bij de enigszins negatieve belasting van het andere molecuul, omdat de tegenovergestelde belastingen worden aangetrokken, en dus gebeurt het met de andere twee zijden.
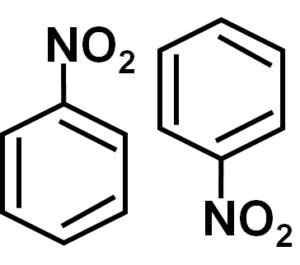 Nitrobenceen -nummer, dat wil zeggen twee moleculen die de neiging hebben om samen in sommige oplosmiddelen samen te zijn. Auteur: Marilú Stea.
Nitrobenceen -nummer, dat wil zeggen twee moleculen die de neiging hebben om samen in sommige oplosmiddelen samen te zijn. Auteur: Marilú Stea. Andere eigenschappen
Het presenteert een geur vergelijkbaar met amandelen of om te polijsten voor schoenen. Door de stollingstemperatuur te verlagen in de vorm van groenachtige gele kristallen.
Het verkrijgen van
Je behandelt de benzeen c6H6 Met een mengsel van salpeterzuur HNO3 en zwavelzuur h2SW4. Het proces wordt nitratie genoemd en omvat de vorming van het nitroniumion niet2+ Dankzij de aanwezigheid van zwavelzuur h2SW4.
- Nitronio ion nr2+:
Hno3 + 2 H2SW4 ⇔ H3OF+ + 2 HSO4- + NEE2+ (Nitronio ion)
- De nitronio -ionen valt benzeen aan:
Kan u van dienst zijn: systematische fout: hoe u het in chemie kunt berekenen, in natuurkunde, voorbeeldenC6H6 + NEE2+ → c6H6NEE2+
- Nitrobenceen wordt gevormd:
C6H6NEE2+ + HSO4- → c6H5NEE2 + H2SW4
Samengevat:
C6H6 + Hno3 → c6H5NEE2 + H2OF
De nitratiereactie van benzeen is zeer exotherme, dat wil zeggen, zeer warmte wordt gegenereerd, dus het is erg gevaarlijk.
Toepassingen
Bij het verkrijgen van aniline en acetaminophen
Nitrobenceen wordt voornamelijk gebruikt om aniline C te synthetiseren6H5NH2, die een veelgebruikte verbinding is voor het bereiden van pesticiden, tandvlees, kleurstoffen, explosieven en medicijnen.
Het verkrijgen van aniline vindt plaats door nitrobenzeen in zuur medium te verminderen in aanwezigheid van ijzer of tin, die wordt uitgevoerd volgens de volgende stappen:
Nitrobenzeen → nitrosobenzeen → fenylhydroxylamine → aniline
C6H5NEE2 → c6H5Nee → C6H5NHOH → C6H5NH2
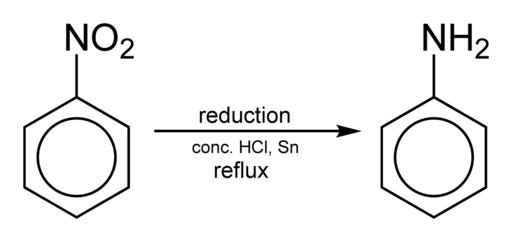 Nitrobenceen reductie om aniline te verkrijgen. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons.
Nitrobenceen reductie om aniline te verkrijgen. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons. Afhankelijk van de omstandigheden kan het proces worden gestopt in een van de tussenliggende stappen bijvoorbeeld in fenylhydroxylamine. Beginnend van fenylhydroxylamine in een sterk zure omgeving, kan para-aminofenol worden bereid:
Fenylhdroxylamine → P-Aminofenol
C6H5NHOH → HOC6H4NH2
De laatste wordt behandeld met azijnzuuranhydride om paracetamol (acetaminophen) een zacht antipyretisch en zacht analgetic te verkrijgen, dat wil zeggen een medicijn om koorts en pijn en pijn te behandelen.
 Soms is het mogelijk om met acetaminophen te mediceren aan kinderen met koorts. Acetaminophen is een nitrobenzeenderivaat. Auteur: Augusto Ordonez. Bron: Pixabay.
Soms is het mogelijk om met acetaminophen te mediceren aan kinderen met koorts. Acetaminophen is een nitrobenzeenderivaat. Auteur: Augusto Ordonez. Bron: Pixabay.  Acetaminophen -pillen, een derivaat van nitrobenzeen. Paracetamol_acetaminophen_500_mg_pils.JPG: Michelle Tribe uit Ottawa, Canadaderivative Work: Anrie [CC by (https: // creativeCommons.Org/licenties/door/3.0)]. Bron: Wikimedia Commons.
Acetaminophen -pillen, een derivaat van nitrobenzeen. Paracetamol_acetaminophen_500_mg_pils.JPG: Michelle Tribe uit Ottawa, Canadaderivative Work: Anrie [CC by (https: // creativeCommons.Org/licenties/door/3.0)]. Bron: Wikimedia Commons. Een andere manier om aniline te verkrijgen is door nitrobenzeen te verminderen met koolmonoxide (CO) in waterig medium in aanwezigheid van zeer kleine deeltjes (nanodeeltjes) van paladium (PD) als katalysator.
C6H5-NEE2 + 3 CO + H2O → C6H5-NH2 + 3 CO2
Bij het verkrijgen van andere chemische verbindingen
Nitobenzeen is het startpunt om een breed scala aan verbindingen te verkrijgen die worden gebruikt, zoals kleurstoffen, pesticiden, medicijnen en cosmetica.
 Sommige kleurstoffen worden verkregen dankzij nitrobenzeen. Auteur: Edith Lüthi. Bron: Pixabay.
Sommige kleurstoffen worden verkregen dankzij nitrobenzeen. Auteur: Edith Lüthi. Bron: Pixabay. Het maakt bijvoorbeeld het mogelijk om 1,3-dinitrobenceen te verkrijgen dat door chlorering (toevoeging van chloor) en reductie (eliminatie van zuurstofatomen) 3-chlooranyline genereert. Dit wordt gebruikt als tussenpersoon voor pesticiden, kleurstoffen en medicijnen.
Nitobenzeen werd gebruikt om benchidine te bereiden die een kleurstof is. Bovendien dient nitrobenzeen om quinoline, azobenzeen, methanylzuur, dyitobenzeen, isocianaat of pyroxiline te bereiden.
In verschillende toepassingen
Nitobenzeen wordt gebruikt of gebruikt als:
Kan u van dienst zijn: onverzadigde koolwaterstoffen- Extractie -oplosmiddel voor de zuivering van smeeroliën die in machines worden gebruikt
- Oplosmiddel voor cellulose -ethers
- Mengselingrediënt tot Poolse metalen
- In zeep
- In mengsels voor Poolse schoenen
- Spuitverfconservator
- Component vloerenpolijstmengsel
- Amandel essentie vervanging
- In de parfumindustrie
- Bij de productie van synthetisch rubber
- Oplosmiddel in verschillende processen
 Nitobenzeen maakt deel uit van sommige mengsels voor Poolse schoenen. D-Kuru [CC BY-SA 3.0 op (https: // creativeCommons.Org/licenties/by-sa/3.0/bij/akte.in)]. Bron: Wikimedia Commons.
Nitobenzeen maakt deel uit van sommige mengsels voor Poolse schoenen. D-Kuru [CC BY-SA 3.0 op (https: // creativeCommons.Org/licenties/by-sa/3.0/bij/akte.in)]. Bron: Wikimedia Commons. Risico's
Nitobenzeen is giftig door inhalatie, inname en absorptie door de huid.
Irriteert de huid, ogen en luchtwegen. Het kan een type bloedarmoede veroorzaken die methemoglobinemie wordt genoemd dat bestaat uit het verminderen van het vermogen van rode bloedcellen om zuurstof in weefsels af te geven en vermoeidheid genereert.
Bovendien veroorzaakt nitrobenceen dyspneu, duizeligheid, overstuur zicht, gebrek aan adem, ineenstorting en dood. Het beschadigt ook de lever, milt, nieren en centraal zenuwstelsel.
Naar schatting kan het een mutagen zijn en mogelijk menselijke kanker veroorzaken, omdat het het bij dieren heeft veroorzaakt.
Bovendien mag nitrobenceen niet worden weggegooid in het milieu. De toxiciteit van dieren, planten en micro -organismen maakt het zeer schadelijk voor ecosystemen.
Toxiciteit naar micro -organismen vermindert de biologische afbreekbaarheid.
Behandelingen voor de eliminatie van het milieu
De vervuiling van het milieu met nitrobenceen kan optreden door de verspilling van de verschillende industrieën die het gebruiken, zoals de kleurindustrie of die van de explosieven.
Nitobenzeen is een zeer giftige en moeilijk af te breken onder natuurlijke omstandigheden, om deze reden kan het ernstige drinkbeenvervuiling veroorzaken en irrigatiesystemen zaaien.
Vanwege de hoge stabiliteit en toxiciteit ten opzichte van micro -organismen, wordt het vaak geselecteerd als een model in rioleringsbehandelingsstudies.
Verschillende manieren worden onderzocht om vervuild water nitrobenzeen te elimineren. Een van hen is door fotokatalytische afbraak, dat wil zeggen het gebruik van zonlicht als een versneller van de afbraakreactie in aanwezigheid van titaniumdioxide van titanium2.
 Met een zonlichtreactor is het mogelijk om watervervuiling te elimineren met nitrobenceen. Mihai-Cosmin Pascariu [CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons.
Met een zonlichtreactor is het mogelijk om watervervuiling te elimineren met nitrobenceen. Mihai-Cosmin Pascariu [CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons. Micro -elektrontrolysemethoden zijn ook met succes getest met een ijzeren katalysator (geloof) en koper (CU) in keramiek. Micro -elektrontrolyse maakt het mogelijk dat nitrobenzeen ontleedt door een elektrische stroom.
Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Nitrobenzeen. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Morrison, r.T. en Boyd, r.N. (2002). Organische chemie. 6e editie. Prentice-Hall.
- Moldaveanu, s.C. (2019). Pyrolyse van andere stikstof-counts verbindingen. In pyrolyse van organische moleculen (tweede editie). Hersteld van Scientedirect.com.
- Smith, p.W.G. et al. (1969). Aromatische nitratie-nitro-verbindingen. Elektrofiele substituties. In aromatische chemie. Hersteld van Scientedirect.com.
- Windholz, m. et al. (Editors) (1983). De Merck Index. Een enyclopedie van chemicaliën, medicijnen en biologisch. Tiende editie. Merck & Co., Inc.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). VIJFDE EDITIE. Deel A22. VCH VerlagSgellschaft MBH.
- Whang, T.-J. et al. (2012). UV-iRadiated fotokatalytische afbraak van nitrobenzeen door titania-binding op kwartsbuis. International Journal of PhotoEnergy, Volume 2012, artikelen ID 681941. Hyndawi hersteld.com.
- Shikata, t. et al. (2014). Nitrobenzeen anti-parallelle dimeervorming in niet-polaire oplosmiddelen. AIP Advances 4, 067130 (2014). Hersteld van Doaj.borg.
- Krogul-Obczak, een. et al. (2019). Vermindering van nitrobenzeen tot aniline door co/h2Of in de getuige van palladium nanodeeltjes. Katalysatoren 2019, 9, 404. MDPI hersteld.com.
- Yang, B. et al. (2019). Productie op pilootschaal, eigenschappen en toepassing van Fe/Cu katalytische-keram-vulling voor nitrobenzeenverbindingen afvalwaterbehandeling. Katalysatoren 2019, 9, 11. MDPI hersteld.com.
- « Formule van mechanische voordeel, vergelijkingen, berekening en voorbeelden
- 110 Eeuwige liefdeszinnen voor vriendjes en echtgenoten »

