Kaliumnitraat (kno3)
- 1781
- 208
- Lonnie Rohan
Wat is kaliumnitraat?
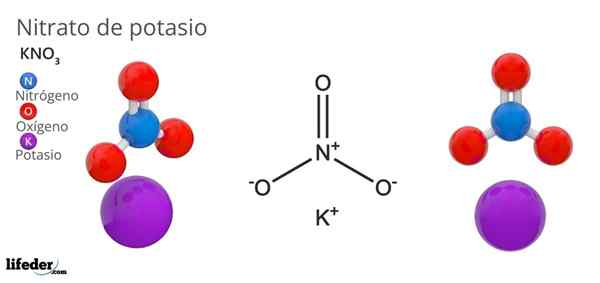
Hij kaliumnitraat Het is een ternair zout bestaande uit kalium, alkalisch metaal en nitraatoxoanion. De chemische formule is kno3, Wat dat betekent dat voor elk K -ion+, Er is geen ion3-- Interactie hiermee. Daarom is het een ionisch zout en vormt het een van de alkalische nitraten (Lino3, Oudere broer3, Rbno3…).
De kno3 Het is een sterk oxidatiemiddel vanwege de aanwezigheid van nitraatanion. Dat wil zeggen, het werkt als een reserve van vaste nitraationen, in tegenstelling tot, in tegenstelling tot andere sterk oplosbare zouten in water of zeer hygroscopisch. Veel van de eigenschappen en toepassingen van deze verbinding zijn te wijten aan het nitraatanion, in plaats van het kaliumkation.
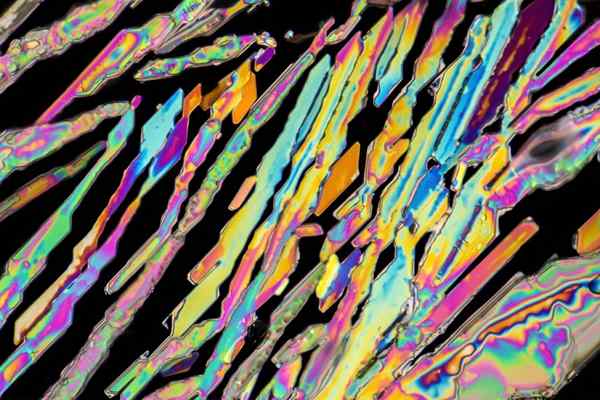 Kaliumnitraatkristallen
Kaliumnitraatkristallen In de bovenste afbeelding worden sommige kristallen van kno geïllustreerd3 met naaldvormen. De natuurlijke bron van kno3 is de zoutpeter, bekend als de namen Salpeter of Ballon, in Engels. Dit element staat ook bekend als Potassa Nitraat of Nitro Mineral.
Het bevindt zich in droge of woestijngebieden, evenals efflorescenties van de caverneuze wanden. Een andere belangrijke bron van kno3 Het is de guano, uitwerpselen van dieren die droge omgevingen bewonen.
Chemische structuur van kaliumnitraat
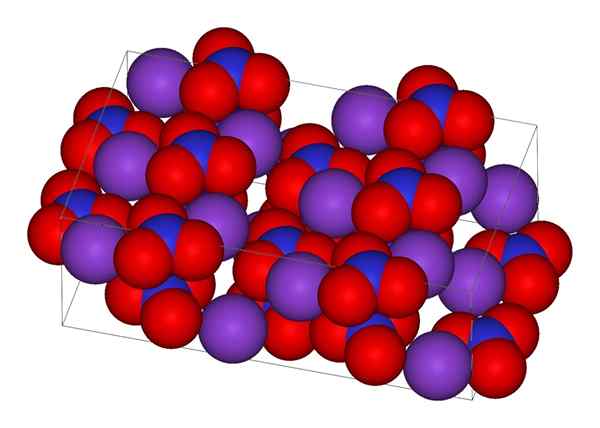 Kristallijne structuur van kaliumnitraat
Kristallijne structuur van kaliumnitraat In het bovenste beeld wordt de kristallijne structuur van de kno weergegeven3. Paarse bollen komen overeen met kionen+, terwijl rood en blauw respectievelijk zuurstof- en stikstofatomen zijn. De kristallijne structuur is ortorrombisch bij kamertemperatuur.
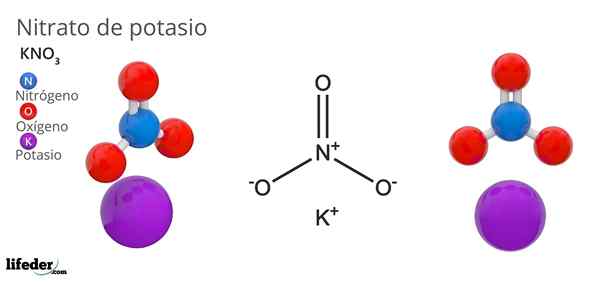
NION GEOMETRIE NO3- Het is dat van een trigonaal vlak, met de zuurstofatomen in de hoekpunten van de driehoek en het stikstofatoom in het midden. Het presenteert een positieve formele belasting in het stikstofatoom en twee negatieve formele belastingen in twee zuurstofatomen (1-2 = (-1)).
Kan u van dienst zijn: eenvoudige microscoopDeze twee negatieve ladingen van NO3- Ze verhuizen tussen de drie zuurstofatomen, waarbij ze altijd de positieve belasting in stikstof behouden blijven. Als gevolg van het bovenstaande, kionen-+ van het kristal vermijden ze niet net boven of onder de stikstof van de anionen niet3-.
In feite laat het beeld zien hoe kionen+ Ze zijn omgeven door zuurstofatomen, rode bollen. Concluderend zijn deze interacties verantwoordelijk voor kristallijne regelingen.
Andere kristallijne fasen
Variabelen zoals druk en temperatuur kunnen deze opstellingen wijzigen en verschillende structurele fasen veroorzaken voor de kno3 (Fasen I, II en III). Fase II is bijvoorbeeld die van het beeld, terwijl fase I (met trigonale kristallijne structuur) wordt gevormd wanneer de kristallen worden verwarmd tot 129 ºC.
Fase III is een overgangsklasse die wordt verkregen uit de koeling van fase I, en sommige onderzoeken hebben aangetoond dat het enkele belangrijke fysieke eigenschappen vertoont, zoals ferro -elektriciteit. In deze fase vormt het kristal kaliumlagen en nitraten, mogelijk gevoelig voor elektrostatische afstotingen tussen ionen.
In de lagen van fase III de anionen nee3- Ze verliezen een beetje van hun vlakke (de driehoek kromt enigszins) om deze opstelling toe te staan, die, vóór een mechanische verstoring, de structuur van fase II wordt.
Kaliumnitraat gebruikt/toepassingen
Zout is van groot belang, omdat het wordt gebruikt in tal van activiteiten van de mens, die zich manifesteren in de industrie, landbouw, voedsel, enz. Deze toepassingen omvatten het volgende:
- Voedselbehoud, vooral vlees. Ondanks het vermoeden dat het tussenbeide komt bij de vorming van nitrosamine (carcinogeen middel) wordt nog steeds gebruikt in Charcuterie.
- Meststof, omdat kaliumnitraat twee van de drie planten macronutriënten levert: stikstof en kalium. Samen met fosfor is dit element noodzakelijk voor de ontwikkeling van planten. Dat wil zeggen, het is een belangrijke en beheersbare reserve van deze voedingsstoffen.
- Versnelt verbranding, het kunnen produceren van explosies als het brandbare materiaal uitgebreid is of als het fijn verdeeld is (groter oppervlak, grotere reactiviteit). Bovendien is het een van de belangrijkste componenten van buskruit.
- Vergemakkelijkt het verwijderen van de aanraking van de talled bomen. Nitraat levert de stikstof die nodig is voor schimmels om het hout van stronken te vernietigen.
- Het komt tussenbeide in de vermindering van de tandgevoeligheid door zijn opname in dentifrices, die de bescherming van pijnlijke sensaties van de tand die wordt geproduceerd door kou, warmte, zuur, snoep of contact verhoogt.
- Grijpt in als een hypotensor bij de regulatie van de bloeddruk bij mensen. Dit effect zou worden gegeven of onderling verbonden met een verandering in natriumuitscheiding. De aanbevolen dosis in de behandeling is 40-80 mEq/dag kalium. In dit opzicht wordt erop gewezen dat kaliumnitraat diuretische actie zou hebben.
Synthese
Het grootste deel van het nitraat wordt geproduceerd in de mijnen van de woestijnen in Chili. Het kan worden gesynthetiseerd door verschillende reacties:
NH4NEE3 (AC) +KOH (AC) => NH3 (AC) +kno3 (AC)+H2Of (l)
Kaliumnitraat neutraliseer ook salpeterzuur met kaliumhydroxide in een zeer exotherme reactie.
KOH (AC) +HNO3(conc) => kno3 (AC) +H2Of (l)
Op industriële schaal wordt kaliumnitraat geproduceerd door een dubbele verplaatsingsreactie.
Oudere broer3 (AC) +KCL (AC) => NaCl (AC) +kno3 (AC)
De hoofdbron van de KCL is van Silvina Mineral, en niet andere mineralen zoals Scannalite of Cainite, die ook zijn samengesteld uit ionische magnesium.
Fysische en chemische eigenschappen
Kaliumnitraat in vaste toestand wordt gepresenteerd als een witte of in de vorm van ortorombische structuurkristallen bij omgevingstemperatuur en trigonaal bij 129 ºC. Het heeft een molecuulgewicht van 101,1032 g/mol, het is toilet en heeft een zoutoplossing.
Het is een zeer oplosbare verbinding in water (316-320 g/liter water, bij 20 ° C), vanwege zijn ionische aard en het gemak van watermoleculen om de k ion k op te lossen+.
De dichtheid is 2,1 g/cm3 bij 25 ºC. Dit betekent dat het ongeveer twee keer dicht is dan water.
De smeltpunten (334 ºC) en koken (400 ºC) zijn indicatief voor de ionische bindingen tussen k+ en niet3-. Ze zijn echter laag in vergelijking met die van andere zouten, omdat kristallijne reticulaire energie lager is voor monovalente ionen (dat wil zeggen met belastingen ± 1), en hebben ook niet erg vergelijkbare maten.
Kan u van dienst zijn: pH -indicatorenHet ontleedt bij een temperatuur dicht bij het kookpunt (400 ° C) om kalium- en moleculaire zuurstof te produceren:
Kno3(S) => kno2(s) + of2(G)
Referenties
- Pubchem. (2018). Kaliumnitraat. Hersteld van PubChem.NCBI.NLM.Nik.Gov
- Cryst Act. (2009). Groei en verfijning met één kristal van fase-III kaliumnitraat, kno3. B65, 659-663.
- Marni Wolfe. (3 oktober 2017). Kaliumnitraatrisico's. Livestrong hersteld.com
- Amethyst Galleries, Inc. (1995-2014). De minerale niter. Galerijen hersteld.com