Apolaire moleculen
- 2531
- 537
- James Dach
De Apolaire moleculen Zij zijn degenen die in hun structuur een symmetrische verdeling van hun elektronen presenteren. Dit is mogelijk als het elektronegativiteitsverschil van zijn atomen klein is, of als de atomen of elektronegatieve groepen hun effecten op de molecuul annuleren.
Niet altijd "apolariteit" is absoluut. Om die reden worden slechte polariteitsmoleculen als apolair beschouwd; dat wil zeggen, het heeft een dipoolmoment µ dicht bij 0. Hier voert u het relatieve veld in: hoe laag moet u zijn zodat een molecuul of verbinding als apolar wordt beschouwd?
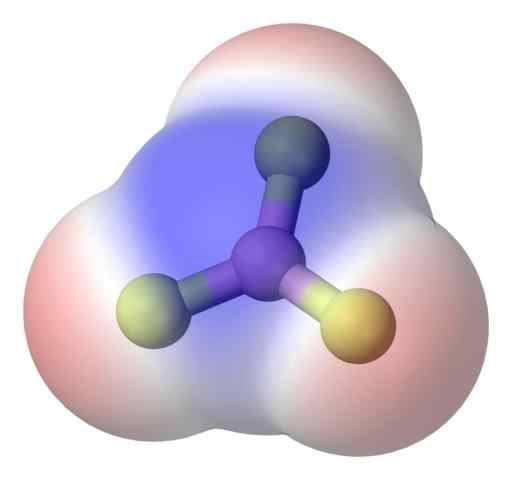
 BF3 Apolair molecuul. Bron: Benjah-bmm27 via Commons Wikimedia.
BF3 Apolair molecuul. Bron: Benjah-bmm27 via Commons Wikimedia. Om het probleem beter aan te pakken, hebt u het boron trifluoride -molecuul, BF3 (bovenste afbeelding).
Het fluoratoom is veel elektronegatiefer dan die van Boro, en daarom zijn de B-F-links polair. Het BF -molecuul3 Het is symmetrisch (trigonaal vlak) en omvat de vector annulering van de drie B-F-momenten.
Aldus worden apolaire moleculen ook gegenereerd, zelfs met het bestaan van polaire links. De gegenereerde polariteit kan worden gebalanceerd door het bestaan van een ander polaire schakel, van dezelfde grootte als de vorige, maar georiënteerd in de tegenovergestelde richting; Zoals het geval is in de BF3.
Kenmerken van een apolair molecuul
Symmetrie
Om de effecten van polaire links te annuleren, moet het molecuul een specifieke geometrische structuur hebben; Bijvoorbeeld lineair, het gemakkelijkst te begrijpen op het eerste gezicht.
Dit is het geval van koolstofdioxide (CO2), die twee polaire links heeft (o = c = o). Dit komt omdat de twee dipoolmomenten van de links C = O worden geannuleerd wanneer de ene op de ene kant is georiënteerd, en de tweede naar de andere, onder een hoek van 180 °.
Kan u van dienst zijn: transaminatieDaarom is een van de eerste kenmerken om rekening mee te houden wanneer de "apolariteit" van een molecuul wordt geëvalueerd door vogelvlucht, om te observeren hoe symmetrisch het is.
Stel dat dat in plaats van CO2 Je hebt de molecule cos (o = c = s), carbonylsulfide genoemd.
Nu is het niet langer een apolair molecuul, omdat zwavel -elektronegativiteit minder is dan zuurstof; En daarom is het dipoolmoment C = S anders dan de c = o. Als gevolg hiervan is de CO's een polair molecuul (de polaire is een bloem van een andere zak).
Het lagere beeld vat grafisch alles samen:
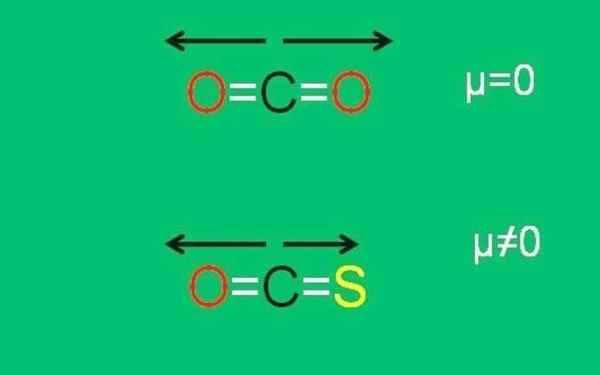 Xxx dipolaire momenten van de CO2- en COS -moleculen. Bron: Gabriel Bolívar.
Xxx dipolaire momenten van de CO2- en COS -moleculen. Bron: Gabriel Bolívar. Merk op dat het dipoolmoment van de link C = S minder is dan de link C = O in de COS -molecuul.
Elektronegativiteit
Elektronegativiteit op de Pauling -schaal heeft waarden tussen 0,65 (voor Francio) en 4,0 (voor fluoride). Over het algemeen hebben halogenen een hoge elektronegativiteit.
Wanneer het verschil in de elektronegativiteit van de elementen die een covalente binding vormen minder dan 0,4 is, wordt gezegd dat het apolair is of niet polair. De enige moleculen die echt apolair zijn, zijn echter die gevormd door verbanden tussen identieke atomen (zoals waterstof, H-H).
Intermoleculaire krachten
Om een stof in het water op te lossen, moet deze elektrostatisch interageren met de moleculen; interacties die geen apolaire moleculen kunnen uitvoeren.
In apolaire moleculen zijn hun elektrische ladingen niet beperkt aan één uiteinde van het molecuul, maar symmetrisch verdeeld (of homogeen). Daarom is hij niet in staat om te communiceren via dipool-dipolo-krachten.
Kan u van dienst zijn: atoomvolumeIn plaats daarvan interageren apolaire moleculen met elkaar via dispersiekrachten in Londen; Dit zijn directe dipolen die de elektronische wolk van aangrenzende moleculen -atomen polariseren. Hier is de moleculaire massa een overheersende factor in de fysische eigenschappen van deze moleculen.
Hoe apolaire moleculen te identificeren?
-Misschien wel de beste methoden om een apolair molecuul te identificeren, is de oplosbaarheid in verschillende polaire oplosmiddelen, die er over het algemeen weinig oplosbaar in zijn.
-Over het algemeen zijn apolaire moleculen van gasvormige aard. Ze kunnen ook niet -mengbare vloeistoffen zijn met water.
-Apolaire vaste stoffen worden gekenmerkt door zacht te zijn.
-De dispersiekrachten die ze bij elkaar houden, zijn meestal zwak. Hierdoor zijn de smeltende of kookpunten meestal lager dan die van polaire verbindingen.
-Apolaire moleculen, vooral in vloeibare vorm, zijn slechte elektriciteitsgeleiders, omdat ze geen netto elektrische lading missen.
Voorbeelden van apolaire moleculen
Edelgassen
Hoewel het geen moleculen zijn, worden edelgassen als apolair beschouwd. Als wordt aangenomen dat twee van zijn atomen gedurende een korte tijdsperioden op elkaar inwerken, kan deze interactie als een molecuul worden beschouwd; molecuul dat apolaire aard zou zijn.
Diatomaire moleculen
Diatomaire moleculen, zoals h2, de br2, de i2, De Cl2, de O2, en f2, Ze zijn apolair. Deze zijn over het algemeen2, A-A.
Koolwaterstoffen
Wat als het een groep atomen was? Het zou zijn voor andere apolaire verbindingen; Bijvoorbeeld ethane, cho3-Ch3, wiens koolstofskelet lineair is, C-C.
Metano, CH4, en het ethaan, c2H6, Het zijn apolaire moleculen. Koolstof heeft een elektronegativiteit van 2,55; Terwijl waterstofelektronegativiteit 2,2 is. Daarom is er een dipoolvector met lage intensiteit, georiënteerd van waterstof tot koolstof.
Het kan u van dienst zijn: Mohr -methode: fundamentals, reacties, procedure, gebruikMaar vanwege de geometrische symmetrie van methaan- en ethaanmoleculen is de som van dipoolvectoren of dipoolmomenten in hun moleculen nietig, dus er is geen netto belasting in de moleculen.
Over het algemeen gebeurt hetzelfde met alle koolwaterstoffen, en zelfs wanneer er onverzadiging in zit (dubbele en drievoudige bindingen), worden ze beschouwd als apolaire of verbindingen van lage polariteit. Ook zijn cyclische koolwaterstoffen apolaire moleculen, zoals cyclohexan of cycobutaan.
Anderen
Koolstofdioxidemoleculen (CO2) en koolstofdisulfide (CS2) Het zijn apolaire moleculen, beide met een lineaire geometrie.
Bij koolstofdisulfide is koolstofelektronegativiteit 2,55, terwijl zwavel -elektronegativiteit 2,58 is; Dus beide elementen hebben praktisch dezelfde elektronegativiteit. Er is geen generatie van een dipoolvector en daarom is de netto belasting nul.
Ook zijn de volgende CCL -moleculen beschikbaar4 en Albr3, Beide apolar:
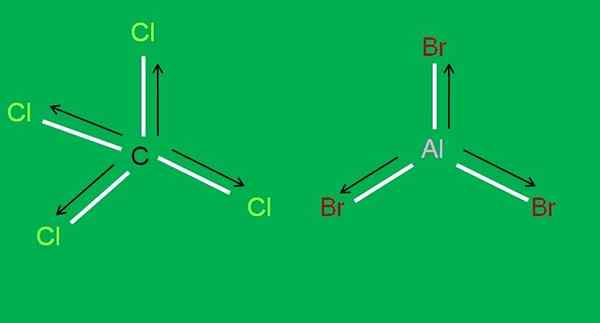 CCL4- en ALBR3 -moleculen. Bron: Gabriel Bolívar.
CCL4- en ALBR3 -moleculen. Bron: Gabriel Bolívar. In aluminium tribromide, albb3 Hetzelfde gebeurt met de BF3, Aan het begin van het artikel. Ondertussen, voor koolstoftetrachloride, CCL4, Geometrie is tetraëdrisch en symmetrisch, omdat alle C-CL-links gelijk zijn.
Evenzo moleculen met de algemene formule CX4 (CF4, CI4 en CBR4), ze zijn ook apolair.
En ten slotte kan een apolair molecuul zelfs octaëdrische geometrie hebben, zoals het geval is met zwavel hexafluoride, sf6. In feite kunt u elke geometrie of structuur hebben, zolang deze symmetrisch is en de elektronische verdeling ervan homogeen is.
Referenties
- Niet -polair molecuul. Hersteld van: chemie.Tutorvista.com
- Voorbeeld van polaire en niet -polaire moleculen. Hersteld van: Thoughtco.com
- « Evenwicht van materie wat is, algemene vergelijking, typen
- Daniel Servitje Montull Biography, Leiderschap en bijdragen »

