Post -structutionele wijzigingen
- 3150
- 860
- Glen Armstrong
Wat zijn post -translationele wijzigingen?
Post -translationele modificaties zijn omkeerbare of onomkeerbare wijzigingen of chemische veranderingen.
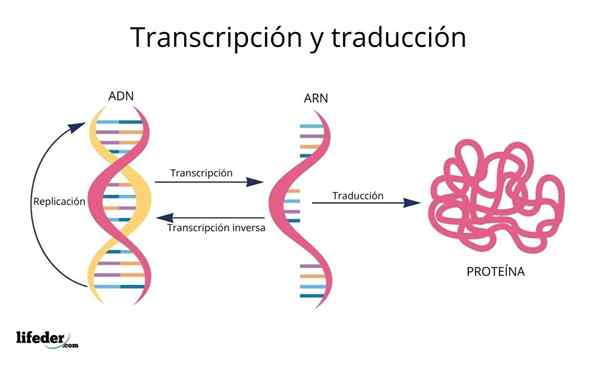
De vertaling is het resultaat van de "lezen en interpretatie" van de informatie in de genen die in de eukaryotische kern worden gevonden (komt ook voor in prokaryoten).
Het genset van een cel -genoom- Het is waar de instructies zijn om alle structurele eiwitten te produceren en de enzymen die worden aangetroffen in het cellulaire interieur, waarvan de processen en vitale functies van elke cel afhankelijk zijn.
De genen worden gevormd door DNA (deoxyribonucleïnezuur), een macromolecuul gevormd door twee complementaire ketens van een polymeer samengesteld uit 4 soorten verschillende moleculen genaamd stikstofbases, Namelijk: Adenina, Timina, Guanina en Cytosine.
DNA is dan een soort van alfabet Met informatie die wordt gelezen en vertaald.
Vóór vertaling is informatie in het DNA eerst getranscribeerd Binnen de kern tot een ander zeer vergelijkbaar molecuul, RNA (ribonucleïnezuur), in de vorm van genaamd moleculen Messenger RNA, die later naar het cytosol worden getransporteerd.
RNA lijkt erg op DNA, maar wordt gevormd door een enkele ketting bestaande uit adenine, uracil, guanine en cytosinestikstofbasis.
De messenger -RNA's, afgeleid van de genetische coderende eiwitsequenties, worden vervolgens "gelezen" en hun sequentie is vertaald In de peptidesequenties van celeiwitten met behulp van ribosomen en andere RNA -moleculen bekend als Overdracht RNA Dat, zoals de naam al aangeeft, Ze overdragen de aminozuren die geschikt zijn voor het eiwit dat wordt gesynthetiseerd.
De volgorde waarin deze aminozuren worden toegevoegd in de ontluikende eiwitten wordt bepaald door de sequentie van de genen die deze coderen, dat wil zeggen in de volgorde van de stikstofbases in de DNA -sequentie.
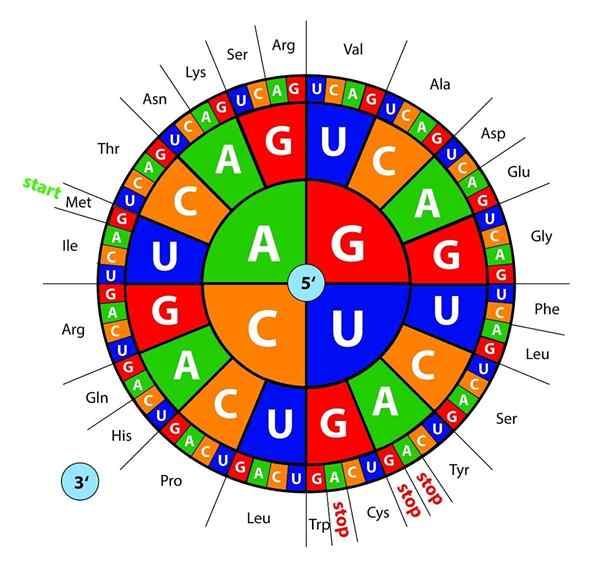
DNA -basen, getranscribeerd als RNA, worden "gelezen" door ribosomen in Trios of Triplets genaamd codons, Elk van die codeert voor een van de 20 aminozuren waarmee eiwitten worden gevormd; Hier is dit genetische code wordt geïnterpreteerd om tegelijkertijd een aminozuur te introduceren.
Post -translationele wijzigingen
De meeste fysicochemische en functionele kenmerken van elk eiwit hangen voornamelijk af van de informatie die in het DNA is gecodeerd.
De cellen slagen er echter in om de diversiteit van hun eiwitten aanzienlijk te vergroten door post -translationele modificaties, die niets meer zijn dan chemische modificaties - gemedieerd door enzymen - die na hun vertaling sommige eiwitten lijden.
Het kan u van dienst zijn: Oxidaseglucose: kenmerken, structuur, functiesDaarom kunnen de kenmerken van sommige eiwitten niet alleen worden afgeleid uit de aminozuursequentie die voortkomt uit genetische informatie.
Deze modificaties komen in het algemeen voor op aminozuurafval dat maakt.
Meer dan 500 post -translationele modificaties zijn beschreven, maar hiervan zijn de bekendste en bestudeerde fosforylering, de vorming van disulfidebruggen, methylering, acetylering, hydroxylering, glycosylatie, prenilatie, ubiquitinatie en carboxylering.
Post -structutioneel aanpassingsproces
De post -translationele modificaties, zoals we hebben opgemerkt, zijn chemische modificaties die lijden aan eukaryotische cel -eiwitten na hun synthese, dat wil zeggen hun vertaling.
Ze hebben over het algemeen te maken met de toevoeging van chemische groepen en/of aanpassing van aminozuurafval dat deel uitmaakt van eiwitten, maar sommige belangrijke wijzigingen hebben ook te maken met de vaststelling van bindingen tussen aminozuren van hetzelfde eiwit, of ook met de eliminatie van aminozuren o peptidentekens door sneden of ClivaJes proteolytisch.
Deze modificaties zijn mogelijk dankzij de aanwezigheid van bepaalde gespecialiseerde cellulaire enzymen en, bovendien, kleine energiesubstraten - het zijn geen spontane reacties - bijvoorbeeld: bijvoorbeeld:
- De ATP (adenosine 5-fosfaat)
- Acetyl co-enzym A (Acetyl Co-A)
- De NAD+ (5'-nicinamide 5'-difosfaat adenosine)
- S-Adenosil Metionina (SAM)
- De 5'-difosfaat uracil N-Acetylglucosamine (udp-grcnac)
- Uracil 5'-glucosedifosfaat (UDP-glucose)
- Onder andere
Enkele van de belangrijkste post -translationele wijzigingen werken als schakelaars ((Suiches) Moleculair die de enzymatische functies van sommige eiwitten activeert of deactiveert, waardoor hun celfunctie of zelfs de intracellulaire locatie reguleert.
Veel eiwitten die tot intracellulaire organellen behoren, worden bijvoorbeeld gesynthetiseerd in de cytosol met n-o-terminale uiteinden die overeenkomen Signaleringssequenties, die worden herkend door andere eiwitten die verantwoordelijk zijn voor het leiden van ze naar het juiste compartiment en onderweg worden deze signalen meestal uit de eiwitstructuur verwijderd.
Een ander zeer opvallend voorbeeld van post -translationele modificaties die te maken hebben met proteolytische clivaje is dat van bepaalde hormonen en enzymen met proteaseactiviteit, die worden gesynthetiseerd als inactieve eiwitten die de proteolytische verwijdering van sommige van hun aminozuren moeten worden om hun actieve vorm te worden.
Geconjugeerde eiwitten
Hoewel ze niet altijd als zodanig worden erkend, zijn andere zeer belangrijke post -transslationele modificaties die welke de vorming van eiwitten omvatten waarvan de structuur bestaat uit een of meer peptideketens geassocieerd met een niet -eiwitse verbinding, hetzij door covalente bindingen of zwakkere interacties en verloop.
Over het algemeen worden deze eiwitten geclassificeerd volgens de identiteit van de niet -eiwitfractie en vereisen dergelijke delen om hun functies uit te voeren.
Het kan u van dienst zijn: bloedagarDeze breuken of porties staan bekend als Prothetische groepen En een goed voorbeeld van deze eiwitten is hemoglobine, gekoppeld aan een hemo -groep.
Endoplasmatisch reticulum in actie
Veel post -translationele modificaties beginnen in het ruwe endoplasmatische reticulum, waarbij bijbehorende ribosomen eiwitten vertalen wanneer ze worden ingebracht in het membraan van deze organel.
In het endoplasmatische reticulum verwerven veel eiwitten hun uiteindelijke structurele conformatie: hun signaalsequenties worden verwijderd, vouwen in de juiste vorm, disulfurbruggen worden gevormd, suikerhoudende groepen worden toegevoegd, enz.
Soorten post -translationele wijzigingen
Meer dan 500 soorten verschillende post -translationele modificaties zijn beschreven in eukaryotische cellen; De volgende lijst groepeert enkele van de meest bestudeerde:
-
Fosforylering
Overdracht van een of meer fosfaatgroepen van hoge energiemoleculen, zoals ATP, naar de aminozuurhydroxylgroep zoals serine, boomonine en tyrosine; Het wordt gemedieerd door de enzymen van de groep van de Mannen eiwitten (Deze fosfaten worden verwijderd door enzymen fosfatasen)).
Het is belangrijk in tal van celgebeurtenissen zoals deling, signaaltransductie, koolhydraatmetabolisme, celgroei en voortgang van de celcyclus, onder andere.
-
Sulfonatie
Dit is de toevoeging van een groep -SO3H (sulfonisch) exclusief in het verspilling van het tyrosine -aminozuur en is typisch voor transmembrale eiwitten of eiwitten die zijn uitgescheiden. Het wordt gekatalyseerd door tyrosil-sulfotransferase-enzymen.
Het is een belangrijk proces voor het functioneren van veel membranale receptoren, voor bepaalde soorten intracellulaire bewegwijzering, enz.
-
Disulfur -brugvorming tussen cysteïnen
Dit proces vindt plaats tussen cysteïneresten en is een van de belangrijkste post -translationele modificaties vanuit het structurele oogpunt. De disulfidebruggen worden vastgesteld in organellen zoals het Golgi -complex en het endoplasmatisch reticulum, die oxiderende omgevingen hebben.
Deze post -translationele modificatie heeft te maken met het opzetten van een bepaalde structurele configuratie die meestal erg belangrijk is voor de activiteit van talloze enzymen.
-
Methylering
Het bestaat uit de toevoeging van methylgroepen in aminozuren zoals lysine, arginine, histidine, glutamine en asparagine (N-methylering), zoals aspartaat en glutamaat (O-methylering) of als cysteïne (S-methylering).
Het komt voor dankzij de katalytische werking van enzymen die bekend staan als N-, O- of S-methyltransferasen. Eiwitmethylering is essentieel voor de regulatie van genetische transcriptie op histone -eiwitniveau, maar speelt ook een lagere rol bij signaaltransductie.
-
Acetylering
Het impliceert de toevoeging van acetylgroepen aan lysineresten van sommige eiwitten. Het wordt gekatalyseerd door acetyltransferase -enzymen en heeft ook zeer belangrijke functies vanuit het oogpunt van de regulatie van genetische expressie (op het niveau van histon -eiwitten, die binden aan DNA).
-
Hydroxylering
Het komt meestal voor in proline-, lysine- en asparagineafval en wordt gekatalyseerd door ijzerafhankelijke hydroxylase-enzymen. De resulterende aminozuren, hydroxyprol en hydroxilisine zijn zeer belangrijk voor de rijping van sommige eiwitten (inclusief collageen) en voor sommige antibioticum- en antischimmelverbindingen (hydroxiasparagine).
-
Glycosylatie
Deze aanpassing is een zeer belangrijk proces voor eukaryotische cellen. Het komt voornamelijk voor op serine- en asparagineafval, maar het kan ook voorkomen op hydroxyprolines of hydroxilisines.
Het kan je dienen: evolutionisme: oorsprong, darwin, sociale, lineaire en culturele evolutionismeHet bestaat uit de toevoeging van koolhydraatmoleculen aan de eiwitstructuur en wordt gekatalyseerd door glycosyltransferase -enzymen en komt vooral voor in excretie -eiwitten en in die gevonden op het celoppervlak.
-
Prenila
Het bestaat uit de overdracht van isaprenilos (lipide) groepen naar sommige eiwitten. De leidinggevende enzymen zijn specifieke transfrases voor elke groep.
Dit proces is belangrijk voor het verankeren van sommige eiwit naar celmembranen, maar komt ook voor tijdens signaaltransductie, enz.
-
Ubiquitinatie
Dit is de covalente toevoeging van een of meerdere kopieën van het peptide dat bekend staat als Ubiquitine. Deze toevoeging merk Naar eiwitten voor afbraak in een eiwitcomplex dat bekend staat als het 26S -proteosoom.
Het vertegenwoordigt een zeer efficiënt intracellulair regulatiesysteem en is verantwoordelijk voor het vernietigen van eiwitten via een ATP-afhankelijke route en met de deelname van drie verschillende enzymenroepen E1, E2 en E3.
Voorbeelden
Fosforylering en glysilatie zijn twee uiterst belangrijke post -translationele modificaties voor het leven van de cellen. Niet alleen omdat ze veel processen besturen die verband houden met communicatie en celcyclus, maar ook omdat ze heel gebruikelijk zijn bij eukaryoten.
P53 -eiwit is bijvoorbeeld een eiwit dat bekend staat als "tumorsuppressor" dat wordt gebruikt tijdens sommige kankerbehandelingen. De activering ervan hangt af van de werking van verschillende kinase-eiwitten die verantwoordelijk zijn voor fosforylering van het N-terminale uiteinde.
Aan de andere kant bevat het eukaryotische celoppervlak een groot aantal glycoproteïnen (post -translationele gemodificeerde eiwitten door de toevoeging van koolhydraten).
Veel van deze eiwitten hebben belangrijke functies in immuunherkenning, in celmigratie, in erkenning en unie tot receptoren, onder andere.
Referenties
- Alberts, B., Bray, D., Hopkin, K., Johnson, a. D., Lewis, J., Raff, m.,… & Walter, p. (2015). Essentiële celbiologie. Slingerwetenschap.
- Cox, m. M., & Nelson, D. L. (2008). Lehninger -principes van biochemie. WH Freeman.
- Garrett, r. H., & Grisham, c. M. (1999). Biochemie.
- Groen, k. D., & Garneau-Tesodikova, s. (2010). Postranslationele modificatie van eiwitten.
- Walsh, c. T., Garneau -Sodikova, s., & Gatto jr, g. J. (2005). Post -translationele eiwitmodificaties: de chemie van proteoomdiversificaties. Angewandte Chemie International Edition, 44 (45), 7342-7372.