Rutherford History Atomic Model, Experimenten, postulaten
- 4072
- 670
- Pete Heaney V
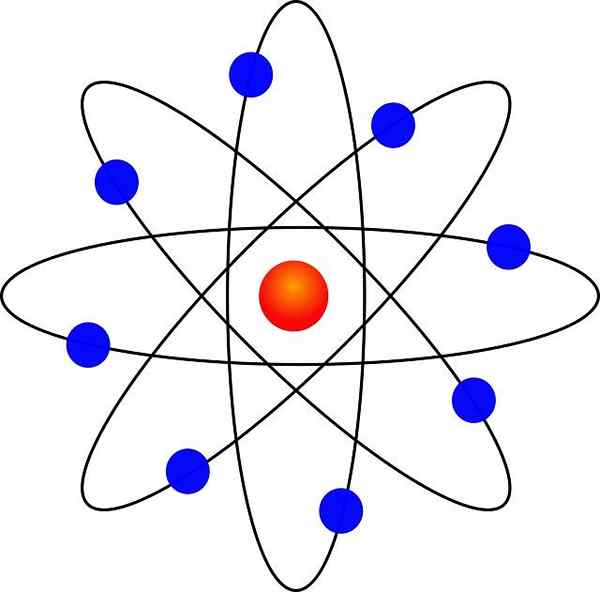
Hij Rutherford Atomic Model Het is de beschrijving van het atoom gecreëerd door de Britse natuurkundige Ernest Rutherford (1871-1937) toen hij in 1911 de atoomkern ontdekte, dankzij de beroemde dispersie-experimenten die zijn genoemd die zijn genoemd.
Het idee van het atoom ("ondeelbaar'In het Grieks) als de kleinste component van materie, was het een intellectuele creatie geboren in het oude Griekenland, ongeveer 300 tot.C. Net als zoveel andere Griekse concepten, is het concept van het atoom ontwikkeld op basis van logica en argumentatie, maar niet om te experimenteren.
 Rutherford Atomic Model
Rutherford Atomic Model De meest opvallende atomistische filosofen waren Democritus van Abdera (460 - 360 v.Chr.), Epicurus van Samos (341 - 270 AC) en Tito Lucrecio (98 - 54 AC). De Grieken bedachten vier verschillende soorten atomen die overeenkwamen met de vier elementen die volgens hen de zaak vormden: lucht, water, aarde en vuur.
Vervolgens zou Aristoteles een vijfde element toevoegen: de ether die de sterren vormde, omdat de andere vier elementen puur terrestrisch waren.
De veroveringen van Alexander de Grote, van wie Aristoteles een leraar was, breidde zijn overtuigingen voor de oude wereld uit, van Spanje tot India en dus eeuwenlang het idee atoom Hij creëerde zijn eigen plek in de wereld van de wetenschap.
[TOC]
Het atoom houdt op ondeelbaar te zijn
De ideeën van de Griekse filosofen over de structuur van het onderwerp werden honderden jaren als zeker gehandhaafd, totdat een Engelse chemicus en leraar genaamd John Dalton (1776-1844) de resultaten van zijn experimenten in 1808 publiceerde.
Dalton was het ermee eens dat de elementen bestaan uit extreem kleine deeltjes, atomen genoemd. Maar het ging verder door te stellen dat alle atomen van hetzelfde element gelijk zijn, ze zijn dezelfde grootte, dezelfde massa en dezelfde chemische eigenschappen, waardoor ze ongewijzigd blijven tijdens een chemische reactie.
Dit is het eerste atoommodel met een wetenschappelijke basis. Net als de Grieken bleef Dalton het atoom als ondeelbaar beschouwen, daarom zonder een structuur. Het genie van Dalton bracht hem echter ertoe een van de grote principes van het behoud van de fysica te observeren:
- In chemische reacties, atomen worden niet gecreëerd of vernietigd, Ze veranderen alleen hun verdeling.
En vestigde de manier waarop chemische verbindingen werden gevormd door "samengestelde atomen" (moleculen):
- Wanneer twee of meer atomen van verschillende elementen worden gecombineerd om dezelfde verbinding te vormen, doen ze dit altijd in massa -verhoudingen gedefinieerd en constant.
De negentiende eeuw was de grote eeuw van elektriciteit en magnetisme. Een paar jaar na de publicaties van Dalton zaaiden de resultaten van enkele experimenten twijfels onder wetenschappers over de ondeelbaarheid van het atoom.
Kan u van dienst zijn: wat is de capacitieve reactantie en hoe deze te berekenen?Kromme buis
De Crookes-buis was een apparaat ontworpen door de Britse chemicus en meteoroloog William Crookes (1832-1919). Het experiment dat boeven in 1875 werd uitgevoerd, bestond uit het plaatsen van, in een buis vol gas bij lage druk, twee elektroden, één genoemd kathode en een ander gebeld anode.
Door een potentieel verschil tussen beide elektroden vast te stellen, scheen gas met een kleur die kenmerkend was voor het gebruikte gas. Dit feit suggereerde dat er een bepaalde specifieke organisatie binnen het atoom was en dat het daarom niet ondeelbaar was.
Bovendien produceerde deze straling een zwakke fluorescentie in de glazen buiswand voor de kathode, waardoor de schaduw van een kruisvormige merkteken in de buis werd gesneden.
Het was een mysterieuze straling die bekend staat als "kathodestralen", die in een rechte lijn naar de anode reisde en die zeer energiek was, in staat was mechanische effecten te produceren, en die afwijkden naar een positief geladen plaat of ook door magneten.
De ontdekking van het elektron
Straling in de buis van de boeven kon niet worden behandeld, omdat deze een negatieve belasting had. Joseph John Thomson (1856 - 1940) vond het antwoord in 1887 toen hij de relatie tussen de belasting en massa van deze straling vond en ontdekte dat het altijd hetzelfde was: 1,76 x 10elf C/kg., Ongeacht het gas dat in de buis is vergrendeld of het materiaal dat wordt gebruikt om de kathode te produceren.
Thomson noemde deze deeltjes lorp. Door zijn massa te meten met betrekking tot zijn elektrische lading, concludeerde het dat elke corpuscle veel kleiner was dan een atoom. Daarom suggereerde hij dat zij deel van hen zouden moeten zijn, waardoor ze de elektron.
De Britse wetenschapper was de eerste die een grafisch model van het atoom schetste, door de tekening van een sfeer met ingevoegde punten, die door zijn vorm de appellatie van "Buddin of Ciruela" kreeg. Maar deze ontdekking bracht andere vragen op:
- Als de zaak neutraal is en het elektron een negatieve belasting heeft: in welk deel van het atoom de positieve belasting is die de elektronen neutraliseert?
- Als de elektronenmassa lager is dan die van het atoom, wat bestaat de rest van het atoom uit?
- Waarom werden de deeltjes verkregen altijd elektronen en nooit van een ander type?
Rutherford -dispersie -experimenten: de atomaire kern en proton
Tegen 1898 had Rutherford twee soorten straling geïdentificeerd uit uranium, die hij belde alfa En bèta.
Natuurlijke radioactiviteit was al ontdekt door Marie Curie in 1896. Alpha -deeltjes hebben een positieve belasting en zijn gewoon heliumkernen, maar op dat moment was het concept van de kern nog niet bekend. Rutherford stond op het punt het te ontdekken.
Kan u van dienst zijn: thermodynamisch systeem: eigenschappen, typen, voorbeeldenEen van de experimenten die Rutherford in 1911 deed aan de Universiteit van Manchester, met de hulp van Hans Geiger, bestond uit het bombarderen van een fijn gouden blad met deeltjes alfa, wiens belasting positief is. Rond het gouden blad plaatste een fluorescerend scherm waarmee ze de effecten van bombardementen konden visualiseren.
Waarnemingen
Rutherford en de assistenten bestudeerden de effecten op het fluorescerende scherm en merkten dat:
- Een hoog percentage alfa -deeltjes kruiste het blad zonder merkbare afwijking.
- Sommigen afwijken op behoorlijk uitgesproken hoeken
- En heel weinig achteruit stuiterde
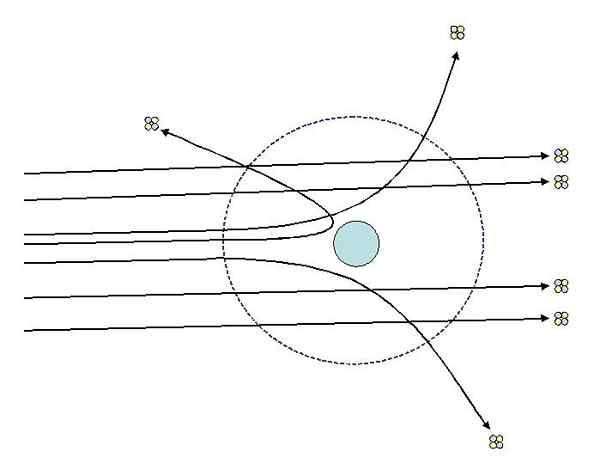 Rutherford dispersie -experimenten. Bron: [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]].
Rutherford dispersie -experimenten. Bron: [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]]. Observaties 2 en 3 verrasten de onderzoekers en brachten hen ertoe aan te nemen dat de persoon die verantwoordelijk is voor de verspreide stralen een positieve lading zou moeten hebben en dat op grond van observatienummer 1, die persoon die de leiding had een veel kleinere omvang had dan die van de alfa -deeltjes.
Rutherford zei zelf in dit opzicht dat het was "... alsof je een 15 -inch marine -projectiel probeerde tegen een vel papier en het projectiel stuiterde terug en sloeg je". Dit kan zeker worden verklaard door het Thompson -model.
Rutherford analyseerde de resultaten vanuit het klassieke standpunt en had het bestaan van de atoomkern ontdekt, waar de positieve last van het atoom dat deze neutraliteit gaf, was geconcentreerd.
Rutherford ging verder met zijn dispersie -experimenten. Tegen 1918 waren het nieuwe doelwit van de alfa -deeltjes de atomen van gasvormige stikstof.
Op deze manier detecteerde het waterstofkernen en wist onmiddellijk dat de enige plaats waar deze kernen van stikstof zelf uit de stikstof zelf konden komen. Hoe was het mogelijk dat waterstofkernen deel uitmaakten van stikstof?
Rutherford suggereerde vervolgens dat de waterstofkern, een element dat al atoomnummer 1 was toegewezen, een fundamenteel deeltje zou moeten zijn. ik bel haar proton, Grieks woord om aan te wijzen Eerst. De ontdekkingen van de atoomkern en het proton zijn dus te wijten aan deze briljante Neozyre.
Postuleert het atoommodel van Rutherford
Het nieuwe model was heel anders dan dat van Thompson. Dit waren zijn postulaten:
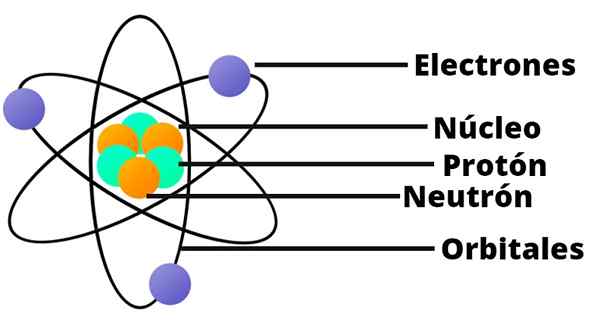
- Het atoom bevat een positief geladen kern, die ondanks dat het erg klein is, bijna de hele massa van het atoom bevat.
- Elektronen draaien de atoomkern op grote afstand en in cirkelvormige of elliptische banen.
- De netto belasting van het atoom is nietig, omdat de ladingen van de elektronen compenseert voor de positieve belasting die aanwezig is in de kern.
De berekeningen van Rutherford wees op een sferische kern en een radio zo klein als 10-vijftien m, de waarde van de atomaire straal ongeveer 100.000 keer hoger, omdat de kernen relatief zeer ver van elkaar ver weg zijn: vanuit de volgorde van 10-10 M.
 De jonge Ernest Rutherford. Bron: Unknown, gepubliceerd in 1939 in Rutherford: zijnde leven en brieven van de RT. Hon. Lord Rutherford, of. M [CC door 4.0 (https: // creativeCommons.Org/licenties/door/4.0)]
De jonge Ernest Rutherford. Bron: Unknown, gepubliceerd in 1939 in Rutherford: zijnde leven en brieven van de RT. Hon. Lord Rutherford, of. M [CC door 4.0 (https: // creativeCommons.Org/licenties/door/4.0)] Dit verklaart waarom de meeste alfa -deeltjes het vel overstaken zonder ongemak of nauwelijks een zeer kleine afbuiging ervaren.
Gezien bij alledaagse objecten zou het atoom van Rutherford bestaan uit een kern van de grootte van een honkbal, terwijl de atomaire straal ongeveer 8 km zou zijn. Daarom kan het atoom worden beschouwd als bijna alles als lege ruimte.
Dankzij de gelijkenis met een miniatuur zonnestelsel stond het bekend als "planetair model van het atoom". De elektrostatische aantrekkingskracht tussen kern en elektronen zou analoog zijn aan de zwaartekrachtattractie tussen de zon en de planeten.
Beperkingen
Er waren echter bepaalde meningsverschillen met betrekking tot sommige waargenomen feiten:
- Als het idee dat de elektronen rond de kern rond de kern worden geaccepteerd, gebeurt het dat het elektron continu straling moet uitzenden totdat het in botsing komt met de kern, met de daaruit voortvloeiende vernietiging van het atoom in veel minder dan een seconde. Dit is gelukkig niet wat er echt gebeurt.
- Bovendien zendt het atoom bij bepaalde gelegenheden bepaalde frequenties van elektromagnetische straling uit wanneer er overgangen zijn tussen een toestand van grotere energie naar één met minder energie, en alleen die frequenties, niet andere, niet andere. Hoe u het feit uitlegt dat energie wordt gekwantiseerd?
Ondanks deze beperkingen en dat er tegenwoordig veel meer geavanceerde modellen zijn en volgens de waargenomen feiten is het atoommodel van Rutherford nog steeds nuttig voor de student om een eerste succesvolle benadering van het atoom en zijn constituerende deeltjes te hebben.
In dit model van het atoom verschijnt neutron niet, een ander bestanddeel van de kern, dat pas in 1932 werd ontdekt.
Korte tijd nadat Rutherford zijn planetaire model had voorgesteld, zou in 1913 de Deense fysicus Niels Bohr hem aanpassen om uit te leggen waarom het atoom niet wordt vernietigd en we zijn er nog steeds hier om dit verhaal te vertellen.
Interessante artikelen
Schrödinger atomair model.
Broglie Atomic Model.
Chadwick Atomic Model.
Heisenberg Atomic Model.
Perrin Atomic Model.
Thomson Atomic Model.
Dirac Jordan Atomic Model.
Democritus Atomic Model.
Bohr Atomic Model.
Dalton Atomic Model.
Referenties
- Rex, a. 2011. Fundamentals of Physics. Pearson. 618-621.
- Zapata, f. 2007. Klasnotities voor de radiobiologie en radiologische beschermingsstoel. Public Health School van de Centrale Universiteit van Venezuela.

