Ionische linkkarakteristieken, hoe vormen en voorbeelden

- 4729
- 1507
- Pete Heaney V
Hij Ionische link Het is een type chemische binding waarin er een elektrostatische aantrekkingskracht is tussen ionen met tegengestelde belasting. Dat wil zeggen, een positief geladen ion vormt een link met een ionen negatief geladen, waardoor elektronen van het ene atoom naar het andere worden overgebracht.
Dit type chemische binding treedt op wanneer de valentie -elektronen van het ene atoom permanent worden overgebracht naar het andere. Het atoom dat elektronen verliest, wordt een kation (positief geladen), en degene die elektronen wint, wordt een anion (negatief geladen).
 Ionische binding voorbeeld: natriumfluoride. Het natrium verliest een Valencia -elektron en geeft het aan fluoride. Wdcf [cc by-s (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Ionische binding voorbeeld: natriumfluoride. Het natrium verliest een Valencia -elektron en geeft het aan fluoride. Wdcf [cc by-s (https: // creativeCommons.Org/licenties/by-sa/3.0)] [TOC]
Ionisch linkconcept
De ionische binding is dat waardoor elektrisch geladen deeltjes, ionen worden genoemd, interactie aangaan om aanleiding te geven tot ionische vaste stoffen en vloeistoffen. Deze link is het product van elektrostatische interacties tussen honderden miljoenen ionen, en is niet alleen beperkt tot een paar van hen; dat wil zeggen, het gaat verder dan de aantrekkingskracht tussen een positieve last voor een negatieve belasting.
Beschouw bijvoorbeeld het ionische samengestelde natriumchloride, NaCl, het beste bekend als tafelzout. In de NaCl overheerst de ionische binding, dus het bestaat uit naionen+ en Cl-. Dan een+ Het is het positieve ion of kation, terwijl de CL- (Chloride) is het negatieve ion of anion.
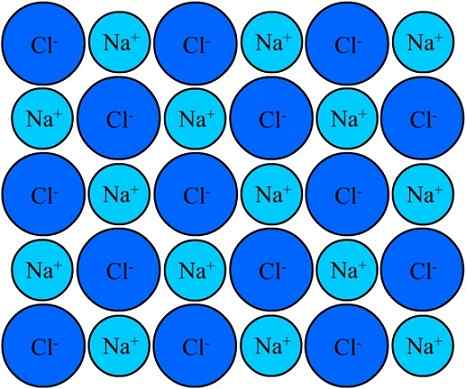 De Na+ en Climes in natriumchloride blijven verenigd dankzij de Ionische Bond. Bron: Eyal Bairay via Wikipedia.
De Na+ en Climes in natriumchloride blijven verenigd dankzij de Ionische Bond. Bron: Eyal Bairay via Wikipedia. Zowel de NA+ Zoals de CL- Ze worden aangetrokken tot tegenovergestelde elektrische kosten. Door de afstanden tussen deze ionen kan anderen naderen, zodat NaCl -paren en paren verschijnen. NA -kationen+ Ze zullen met elkaar afstoten omdat ze van gelijke ladingen zijn, en hetzelfde gebeurt met elkaar met de cl anions-.
Er komt een tijd dat miljoenen naions+ en Cl- Ze slagen erin om te verenigen, samenhangen, om een structuur zo stabiel mogelijk te ontstaan; Een geregeerd door de ionische link (superieure afbeelding). NA -kationen+ Ze zijn kleiner dan cl anions- Vanwege de groeiende effectieve nucleaire kracht van zijn kern op externe elektronen.
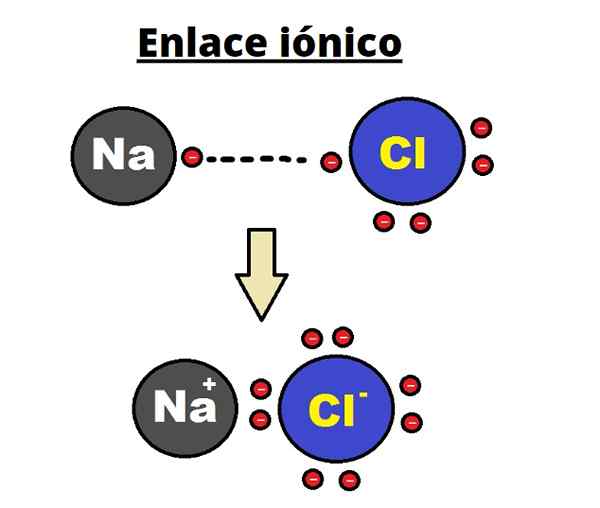 NaCl Ionische link. Rhannosh/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0)
NaCl Ionische link. Rhannosh/cc by-sa (https: // creativeCommons.Org/licenties/by-sa/3.0) De ionische binding wordt gekenmerkt door geordende structuren vast te stellen waar de afstand tussen de ionen (NA+ en Cl- In het geval van NaCl) is het klein in vergelijking met die van andere vaste stoffen. Er is sprake van een ionische kristallijne structuur.
Hoe is een ionische link?
De ionische binding vindt alleen plaats als er een elektronenverdeling plaatsvindt, zodat ionenbelastingen ontstaan. Dit type link kan nooit optreden tussen neutrale deeltjes. Er moeten noodzakelijkerwijs kationen en anionen zijn. Maar waar komen ze vandaan?
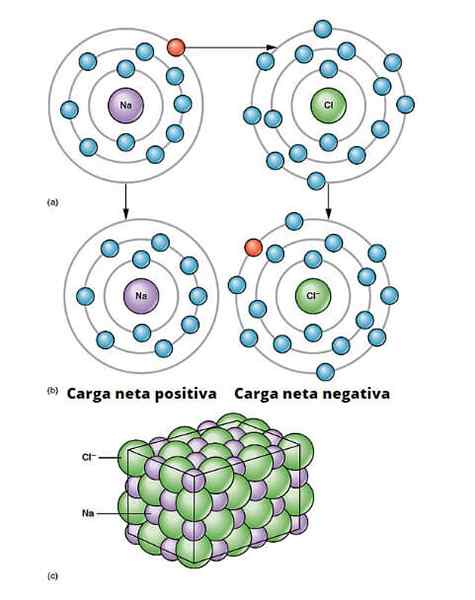 Ionische link illustratie. A) Natrium heeft een negatieve netto belasting. b) Natrium geeft een elektron aan chloor. Het natrium is met een positieve netto belasting en het chloor met negatieve netto belasting, waardoor de ionische binding wordt gegenereerd. Dit type verband tussen miljoenen NA- en Cl -atomen geeft aanleiding tot fysiek zout. OpenX College/CC door (https: // creativeCommons.Org/licenties/door/3.0)
Ionische link illustratie. A) Natrium heeft een negatieve netto belasting. b) Natrium geeft een elektron aan chloor. Het natrium is met een positieve netto belasting en het chloor met negatieve netto belasting, waardoor de ionische binding wordt gegenereerd. Dit type verband tussen miljoenen NA- en Cl -atomen geeft aanleiding tot fysiek zout. OpenX College/CC door (https: // creativeCommons.Org/licenties/door/3.0) Er zijn veel manieren waarop ionen ontstaan, maar in wezen zijn velen gebaseerd op een oxidatiereductie-reactie. De meeste anorganische ionische verbindingen bestaan uit een metalen element met een niet -metalen element (die van het blok P van het periodiek systeem).
Het metaal moet oxideren, elektronen verliezen, om te transformeren in een kation. Aan de andere kant wordt het niet -metalen element verminderd, wint deze elektronen en wordt een anion. De volgende afbeelding illustreert dit punt voor de vorming van NaCl van natrium- en chlooratomen:
Kan u van dienst zijn: arseenzuur (H3SO4): eigenschappen, risico's en gebruik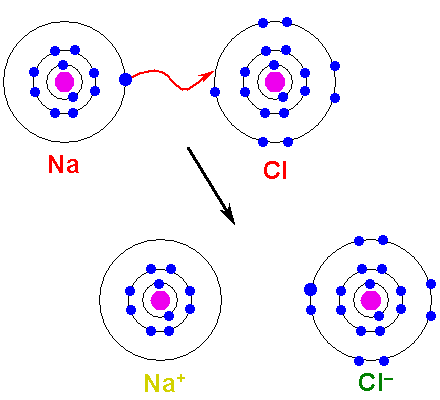 Vorming van een ionische link. Bron: Shafei bij Arabisch Wikipedia / Public Domain
Vorming van een ionische link. Bron: Shafei bij Arabisch Wikipedia / Public Domain De NA Atom doneert een van zijn Valencia -elektronen aan de CL. Wanneer deze elektronenverdeling plaatsvindt, worden na ionen gevormd+ en Cl-, die onmiddellijk en elektrostatisch beginnen aan te trekken.
Er wordt daarom gezegd dat na+ en Cl- Ze delen geen paar elektronen, in tegenstelling tot wat kan worden verwacht voor een hypothetische NA-C-covalente binding.
Ionische linkseigenschappen
De ionische binding is niet -directioneel, dat wil zeggen, de sterkte is niet aanwezig in een enkele richting, maar wordt gepropageerd door ruimte op basis van de afstanden die de ionen scheiden. Dit feit is belangrijk, omdat het betekent dat de ionen sterk verenigd zijn, wat verschillende van de fysieke eigenschappen van ionische vaste stoffen verklaart.
Smeltpunt
De ionische binding is verantwoordelijk voor zout tot een temperatuur van 801 ºC. Deze temperatuur is aanzienlijk hoog in vergelijking met de fusiepunten van verschillende metalen.
Dit komt omdat NaCl voldoende warmte moet absorberen, zodat zijn ionen vrij buiten hun kristallen beginnen te stromen; dat wil zeggen, de attracties tussen Na moeten worden overwonnen+ en Cl-.
Kookpunt
De fusie- en kookpunten van ionische verbindingen zijn vooral hoog product van hun sterke elektrostatische interacties: hun ionische binding. Omdat deze link echter veel ionen omvat, wordt dit gedrag meestal toegekend aan intermoleculaire krachten, en niet goed aan de ionische binding.
In het geval van zout, zodra de NaCl is gesmolten, wordt een vloeistof verkregen uit dezelfde initiële ionen; Alleen nu bewegen ze met grotere vrijheid. De ionische link is nog steeds aanwezig. Na ionen+ en Cl- Ze ontmoeten elkaar op het oppervlak van de vloeistof om een grote oppervlaktespanning te creëren, waardoor ionen niet aan de gasfase ontsnappen.
Daarom moet gesmolten zout de temperatuur verder verhogen om te koken. Het kookpunt van NaCl is 1465 ºC. Bij deze temperatuur overschrijdt de warmte de attracties tussen NA+ en Cl- In de vloeistof beginnen ze dampen te vormen met een druk gelijk aan atmosferisch.
Elektronegativiteit
Eerder werd gezegd dat de ionische binding wordt gevormd tussen een metaalelement en een niet -metalen element. Samenvattende accounts: tussen een metaal en een niet -metaal. Gewoonlijk is dit in termen van anorganische ionische verbindingen; Bovenal, die van binair type, zoals NaCl.
Voor elektronenverdeling (NA+Klet-) en geen delen (NA-CL), er moet een groot elektronegativiteitsverschil zijn tussen beide atomen. Anders zou er geen ionische link tussen hen twee zijn. Mogelijk de NA- en CL -benadering, interageren, maar onmiddellijk de CL, voor zijn grotere elektronegativiteit, "snelt" een elektron naar de NA.
Dit scenario is echter alleen van toepassing op binaire verbindingen, MX, zoals NaCl. Voor andere zouten of ionische verbindingen zijn hun trainingsprocessen ingewikkelder en kunnen ze niet worden aangepakt vanuit een louter atomair of moleculair perspectief.
Het kan u van dienst zijn: AlquinosJongens
Er zijn geen verschillende soorten ionische bindingen, omdat het elektrostatische fenomeen puur fysiek is, alleen variërend van de manier waarop de ionen op elkaar inwerken, of het aantal atomen dat ze bezitten; dat wil zeggen, als het monoatomische of polyiatomische ionen zijn. Ook veroorzaakt elk element of verbinding een karakteristieke ion die de aard van de verbinding definieert.
In het gedeelte Voorbeelden zal dit punt worden verdiept en het zal zijn te zien dat de ionische link in alle verbindingen in wezen hetzelfde is. Wanneer dit niet wordt vervuld, wordt gezegd dat de ionische binding een bepaald covalent karakter heeft, wat het geval is van veel overgangsmetalen, waarbij de anionen worden gecoördineerd met kationen; Bijvoorbeeld FECL3 (Vertrouwen3+-Klet-)).
Voorbeelden van ionische links
Verschillende ionische verbindingen worden hieronder vermeld en hun ionen en verhoudingen worden benadrukt:
- Magnesium chloride
Mgcl2, (Mg2+Klet-), In een 1: 2 verhouding (mg2+: 2 Cl-))
- Kaliumfluoride
KF, (k+F-), In een 1: 1 aandeel (k+: F-))
- Natriumsulfide
NA2S, (NA+S2-), In een aandeel 2: 1 (2e+: S2-))
- Lito Hydroxide
Lioh, (li+Oh-), In een 1: 1 aandeel (li+: Oh-))
- Calciumfluoride
Café2, (AC2+F-), In een 1: 2 aandeel (CA2+: 2f-))
- Natriumcarbonaat
NA2CO3, (NA+CO32-), In een aandeel 2: 1 (2e+: CO32-))
- Calciumcarbonaat
Dief3, (AC2+CO32-), In een 1: 1 aandeel (CA2+: CO32-))
- Kaliumpermanganaat
Kmno4, (K+MNE4-), In een 1: 1 aandeel (k+: Mn4-))
- Kopersulfaat
Cuso4, (Cu2+SW42-), In een 1: 1 aandeel (cu2+: DUS42-))
- Bariumhydroxide
Ba (oh)2, (BA2+Oh-), In een 1: 2 verhouding (ba2+: Oh-))
- Aluminium bromide
Alb3, (Naar de3+BR-), in een 1: 3 aandeel (tot3+: 3BR-))
- IJzeroxide (iii)
Vertrouwen2OF3, (Vertrouwen3+OF2-), In een aandeel 2: 3 (2fe3+: 32-))
- Strontiumoxide
SRO, (SR2+OF2-), In een 1: 1 aandeel (SR2+: OF2-))
- Zilveren chloride
Agcl, (Ag+Klet-), In een 1: 1 aandeel (Ag+: Cl-))
- Anderen
-Ch3Cona, (kies3Coo-NA+), In een 1: 1 aandeel (cho3Coo-: NA+))
- NH4Ik, (NH4+Je-), In een 1: 1 aandeel (NH4+: Yo-))
Elk van deze verbindingen vertoont een ionische binding waarbij miljoenen ionen, overeenkomend met hun chemische formules, elektrostatisch worden aangetrokken en een vaste stof worden aangetrokken. Hoe groter de grootte van zijn ionische belastingen, hoe intenser de attracties en elektrostatische afstotingen zullen zijn.
Daarom is een ionische binding de neiging sterker te zijn, hoe groter de ladingen van de ionen die de samenstelling vormen.
Kan u van dienst zijn: alkenesOpgeloste oefeningen
Sommige oefeningen die de basiskennis van de ionische link plaatsen, worden hieronder opgelost.
- Oefening 1
Welke van de volgende verbindingen is ionisch? De opties zijn: hf, h2Of, nee, h2S, NH3 en MGO.
Een ionische verbinding moet per definitie een ionische binding hebben. Hoe groter het verschil in elektronegativiteit tussen zijn componentenelementen, hoe groter het ionische karakter van de genoemde link.
Daarom worden opties die geen metaalelement hebben in principe weggegooid: HF, H2Of h2S en NH3. Al deze verbindingen worden alleen gevormd door niet -metalen elementen. Het kation NH4+ Het is een uitzondering op deze regel, omdat het geen metaal heeft.
De resterende opties zijn NAH en MGO, die respectievelijk NA- en MG -metalen hebben, verenigd tot niet -metalen elementen. NAH (NA+H-) en mgo (mg2+OF2-) Het zijn ionische verbindingen.
- Oefening 2
Overweeg de volgende hypothetische verbinding: Ag (NH4))2CO3Je. Wat zijn uw ionen en in welke verhouding zijn er in de vaste stof?
Het ontbinden van de verbinding op hun ionen die we hebben: Ag+, NH4+, CO32- en ik-. Deze worden elektrostatisch verbonden na het aandeel 1: 2: 1: 1 (Ag+: 2nh4+: CO32-: Yo-)). Betekent dat de hoeveelheid kationen NH4+ Het is het dubbele van dat voor ag -ionen+, CO32- en ik-.
- Oefening 3
Welke van de volgende verbindingen zou in principe worden verwacht dat de sterkste ionische link had? De opties zijn: KBR, CAS, NA2SW4, Cuo, Alpo4 en PB3P4.
De KBR is samengesteld uit kionen+ en br-, Met een omvang van belasting. Dan heeft CAS de ca ionen2+ en s2-, Met dubbele magnitude -belastingen, dus men kan worden gedacht dat de ionische link in CAS sterker is dan in KBR; En ook sterker dan in Na2SW4, Omdat deze uit na ionen is samengesteld+ En dus42-.
Zowel CAS als CUO kunnen een gelijk sterke ionische link hebben, omdat beide ionen met dubbele magnitude -belastingen bevatten. Dan hebben we alpo4, met ionen al3+ en PO43-. Deze ionen hebben drievoudige magnitude -belastingen, dus de ionische link in Alpo4 Het zou sterker moeten zijn dan in alle bovenstaande opties.
En tot slot hebben we de winnaar PB3P4, Nou, als we aannemen dat het wordt gevormd door ionen, worden ze PB4+ En P3-. Hun ladingen hebben de grootste magnitudes; En daarom PB3P4 Het is de verbinding die waarschijnlijk de sterkste ionische binding heeft.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2020). Ionenbinding. Opgehaald uit: in.Wikipedia.borg
- Helmestine, Anne Marie, pH.D. (11 februari 2020). Ionische versus covalent bindingen - Begrijp het verschil. Hersteld van: Thoughtco.com
- De redacteuren van Enyclopaedia Britannica. (31 januari 2020). Ionenbinding. Encyclopædia Britannica. Hersteld van: Britannica.com
- Chemicool Dictionary. (2017). Definitie van ionische binding. Hersteld van: chemicool.com
- « Granrataria -evenwichtsfuncties, onderdelen en hoe deze te gebruiken
- Rutherford History Atomic Model, Experimenten, postulaten »

