Myofilamententypen, structuur en organisatie
- 4870
- 1474
- Pete Heaney V
De Myofilamenten Het zijn de contractiele eiwitten van myofibrillen, de structurele eenheden van spiercellen, langwerpige cellen die spiervezels worden genoemd.
Spiervezels en hun componenten hebben bepaalde namen. Membraan, cytoplasma, mitochondriën en endoplasmatisch reticulum staan bijvoorbeeld bekend als respectievelijk sarcolema, sarcoplasma, sarcosomen en sarcoplasmatisch reticulum.
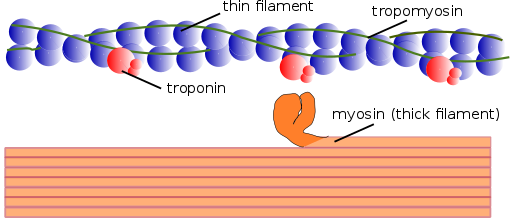
 Myofilaments -structuur (Bron: Mikael Häggström, gebruikt met toegestane. [Public Domain] Via Wikimedia Commons)
Myofilaments -structuur (Bron: Mikael Häggström, gebruikt met toegestane. [Public Domain] Via Wikimedia Commons) Op dezelfde manier worden de contractiele elementen binnenin samen myofibrillen genoemd; en de contractiele eiwitten die myofibrillen vormen, worden myofilamenten genoemd.
Er zijn twee soorten myofilamenten: dunne en diktes. Dunne filamenten bestaan voornamelijk uit drie eiwitten: actine F, tropomiosine en troponine. Dikke filamenten zijn ondertussen alleen samengesteld uit een ander eiwit dat bekend staat als Myosina II.
Bovendien zijn er andere eiwitten geassocieerd met zowel dikke als dunne filamenten, maar deze hebben geen contractiele functies, zo niet nogal structureel, waaronder, om er maar een paar titine en nebuline te noemen.
[TOC]
Soorten spiervezels
De specifieke opstelling van myofilamenten die myofibrillen vormen, geeft aanleiding tot twee soorten spiervezels: gestreepte spiervezels en gladde spiervezels.
Gehouden spiervezels vertonen bij het onderzoeken van een optische microscoop een patroon van strier- of transversale banden die langs het hele oppervlak worden herhaald en die de naam toekennen, aan de spier die ze bevat, van gestreepte spieren. Er zijn twee soorten gestreepte spiervezels, skelet en hart.
Spiervezels die niet laten zien dat het patroon van kruisbanden gladde vezels wordt genoemd. Zij zijn degenen die het spierstelsel vormen van vasculaire muren en ingewanden.
Structuur
Dunne myofilamenten
Deze myofilamenten zijn samengesteld uit actine F en twee bijbehorende eiwitten: tropomiosine en troponine, die regulerende functies hebben.
Actine F, of filamenteuze actine is een polymeer van een ander kleiner bolvormig eiwit genaamd actine G of bolvormig actine, van ongeveer 42 kDa molecuulgewicht. Het heeft een vakbondslocatie voor myosine en wordt bevolen om twee ketens te vormen die zijn gerangschikt als een dubbele propeller die ongeveer 13 monomeer per beurt bestaat.
Het kan u van dienst zijn: proteolyse: typen en functiesActine F -filamenten worden gekenmerkt door twee polen te hebben: een positieve, gericht op schijf Z, en een ander negatief, gerangschikt naar het midden van de sarcomero.
Tropomiosine bestaat ook uit een dubbele dubbele propeller polypeptideketen. Het is een 64 kDa -eiwit dat filamenten vormt die zich in de voren bevinden die zijn achtergelaten door de dubbele propellerketens van de dunne filamenten van actine F, zoals het "vullen" van de lege ruimtes in de propeller.
In rust bedekt tropomiosine de vakbondslocaties van actine voor myosine, waardoor de interactie van beide eiwitten wordt voorkomen, wat spiercontractie veroorzaakt. Rond elke dunne gloeidraad en ongeveer 25 of 30ηm vanaf het begin van elk tropomiosine is een ander eiwit dat troponine wordt genoemd.
Troponine (TN) is een eiwitcomplex dat bestaat uit drie subeenheden van bolvormige polypeptiden genaamd troponine T, C en i. Elk tropomiosinemolecuul heeft een bijbehorend troponine -complex dat het reguleert, en samen zijn ze verantwoordelijk voor de regulering van het begin en voltooiing van spiercontractie.
Dikke myofilamenten
Dikke filamenten zijn myosine II -polymeren, die 510 kDa weegt en wordt gevormd door twee zware ketens van 222 kDa elk en vier lichte ketens. Lichtketens zijn van twee soorten: essentiële lichte ketens, 18 kDa en regelgevende lichte ketens van 22 kDa.
Elke zware keten van Myosina II heeft de vorm van een stok met een kleine bolvormige kop aan het einde dat bijna 90⁰ wordt geprojecteerd en twee fixeersites heeft, een voor actine en een voor de ATP. Dit is de reden waarom deze eiwitten tot de familie Atasas behoren.
Een dikke gloeidraad bestaat uit meer dan 200 Myosin II -moleculen. De bolvormige kop van elk van deze moleculen werkt als een "roeien" tijdens de samentrekking, waardoor de actine wordt geduwd waaraan het is gekoppeld zodat het naar het midden van de sarcomero glijdt.
Organisatie
In een skeletspiervezel bezetten myofibrillen het grootste deel van het sarcoplasma en zijn ze gerangschikt in longitudinale en geordende sets door de cel.
Kan u van dienst zijn: mitochondriaIn een longitudinale snit gezien met een optische microscoop, worden lichte banden, banden I en donkere banden genaamd Banden A Bands waargenomen. Deze banden komen overeen met de geordende beschikking van myofibrillen, en daarom van de myofilamenten die ze samenstellen.
In het midden van de band I is er een donkere en dunne lijn genaamd lijn of disc z. Het midden van elke band a presenteert een duidelijker gebied dat bekend staat als band H, dat centraal wordt gedeeld door een donkere lijn genaamd M -lijn.
Afgebakend tussen twee z -lijnen, wordt een structuur genaamd Sarcomer beschreven, wat de functionele eenheid van de skeletspier is. Een sarcomer bestaat uit de contractiele myofilamenten gerangschikt in banden A, H en een hemi-band I aan elk uiteinde.
Banden Ik bevatten alleen dunne filamenten, de band bevat dikke filamenten met elkaar verbonden aan hun twee uiteinden met fijne filamenten en de band H bevat alleen dikke filamenten.
Hoe worden myofilamenten georganiseerd in sarcomeres?
Zowel dikke myofilamenten als dunne myofilamenten kunnen worden waargenomen bij het onderzoeken van een skeletspiermonster bij elektronische microscoop. Er wordt gezegd dat deze die "interdign" of "met elkaar verweven" met elkaar zijn in een sequentiële, ordelijke en parallelle disposition.
De dunne filamenten zijn afkomstig van de Z -schijven en strekken zich uit naar elke zijde in de tegenovergestelde richting en naar het midden van elke aangrenzende sarcomere. Van de Z -schijven aan elk uiteinde van de sarcomero, in de ontspannen spier, bereikt de actine het begin van de band H aan elke kant.
Dus, in de spiervezels van de skeletspier ontspannen dikke myofilamenten bezetten het centrale gebied dat de donkere banden of banden a vormt; En de dunne filamenten strekken zich uit aan beide zijden van de sarcomer zonder het midden ervan te bereiken.
In een kruising in het gebied waar de dikke en dunne filamenten overlappen, kan een zeshoekig patroon worden waargenomen dat de dikke gloeidraad in het midden omvat en zes dunne filamenten die omringen, en die zich in elk van de zeshoekige randen van de zeshoek.
Kan u van dienst zijn: simplasto: onderdelen en kenmerkenDeze organisatie van myofilamenten in de sarcomere wordt bewaard door de functie van een reeks eiwitten geassocieerd met myofilamenten en die structurele functies hebben, waaronder de titine, de alfa -actine, de nebuline, de miomesine en het eiwit C kunnen worden benadrukt.
Samentrekkingsmechanisme
Wanneer acetylcholine (een neurotransmitter) wordt afgegeven in de neuromusculaire plaat vanwege de stimulatie van een motorneuron, is de spiervezel opgewonden en worden de spanningsafhankelijke calciumkanalen van de sarcoplasmatische reticulo's geopend.
Calcium bindt aan troponine C, en dit genereert een conformationele verandering in tropomiosine, die actieve locaties blootlegt, waardoor de contractie wordt geïnitieerd. Wanneer de calciumniveaus dalen, keert tropomiosine terug naar zijn initiële positie en stopt de samentrekking.
De blootstelling van de vakbondslocaties van de actine met myosine stelt beide eiwitten toe om deel te nemen en dat myosine de actine naar het midden van de sarcomere duwt, glijdend over myosine.
Tijdens spiercontractie benaderen de z -lijnen van elke sarcomer het centrum, naderende lijn M, toenemende interdigitatie tussen actine en myosine en het verminderen van de grootte van banden I en H. De mate van verkorting zal afhangen van de som van de verkorting van elk van de sarcomers van de gecontracteerde spier.
Referenties
- Berne, r., & Levy, m. (1990). Fysiologie. Mosby; Internationale editie.
- Fox, s. Je. (2006). Menselijke fysiologie (9e ed.)). New York, VS: McGraw-Hill Press.
- Gartner, l., & Hiatt, J. (2002). Histologie Atlas Tekst (2e ed.)). Mexico D.F.: McGraw-Hill Inter-Amerikaanse editors.
- Murray, r., Bender, D., Botham, k., Kennelly, p., Rodwell, V., & Weil, p. (2009). Harper's geïllustreerde biochemie (28e ed.)). McGraw-Hill Medical.
- Rawn, J. D. (1998). Biochemie. Burlington, Massachusetts: Neil Patterson Publishers.
- Ross, m., & Pawlina, W. (2006). Histologie. Een tekst en atlas met gecorreleerde cel- en moleculaire biologie (5e ed.)). Lippinott Williams & Wilkins.
- West, J. (1998). Fysiologische basis van de medische praktijk (12ava ed.)). Mexico D.F.: Pan -Aricaans medisch redactioneel.
- « Promielocito -kenmerken, functies en pathologieën
- Giraffe -kenmerken, habitat, reproductie, voedsel »

