De helft van de basis, voorbereiding, gebruik en beperkingen
- 4458
- 247
- Ernesto McKenzie
Hij De helft van of glucosefermentatie is een semi-solide agar die speciaal is ontworpen voor de studie van oxidatief en fermentatief metabolisme van koolhydraten in een belangrijke groep micro-organismen verschillend van enterobacteriën, niet-enteréric negatieve bacillen genoemd,.
Het is gemaakt door Hugh en Leifson; Deze onderzoekers realiseerden zich dat conventionele media voor de studie van zuurproductie uit koolhydraten niet geschikt waren voor deze specifieke groep bacteriën.
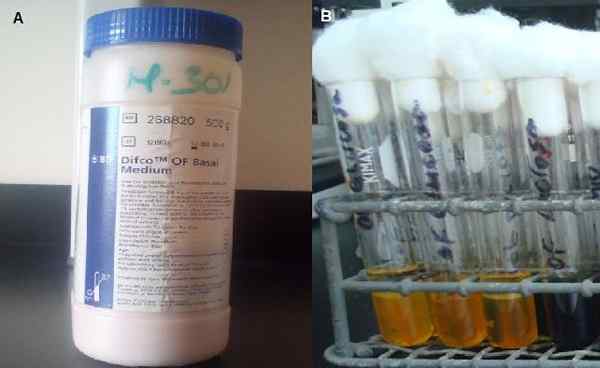
 NAAR. Midden in basale commercial. B. Buizen met de helft van gezaaid. Bron: A en B Foto's gemaakt door de auteur MSC. Marielsa Gil.
NAAR. Midden in basale commercial. B. Buizen met de helft van gezaaid. Bron: A en B Foto's gemaakt door de auteur MSC. Marielsa Gil. Dit komt omdat niet -entererische negatieve bacillen meestal lage hoeveelheden zuren produceren, in tegenstelling tot Enterobacteria.
In die zin heeft het medium van speciale kenmerken die de kleine hoeveelheden zuur kunnen detecteren, zowel door oxidatief als fermentatief. Deze verschillen zijn gerelateerd aan de hoeveelheid peptones, koolhydraten en agar.
Dit medium bevat minder peptonas en een grotere concentratie koolhydraten, op deze manier worden de producten die het medium alkheat verminderd als gevolg van het metabolisme van de eiwitten en de productie van zuren wordt verhoogd door het gebruik van koolhydraten.
Aan de andere kant bevordert de afname van de hoeveelheid agar de verspreiding van het door het gehele medium geproduceerde zuur, naast het observeren van motiliteit.
Het medium is samengesteld uit pepton, natriumchloride, bromotimol blauw, dipotassiumfosfaat, agar en een koolhydraat. De meest voorkomende koolhydraat is glucose, maar anderen kunnen worden gebruikt volgens degene die je wilt bestuderen, zoals lactose, maltose, xylose, onder andere.
[TOC]
Basis
Zoals bij elke kweek manier van kweek, moet het milieu voedingsstoffen bevatten die bacteriegroei garanderen; Deze stoffen zijn peptones.
Van zijn kant levert koolhydraten energie en dient tegelijkertijd het gedrag van het micro -organisme ertegen, dat wil zeggen, het maakt het mogelijk om de bacteriën te classificeren als een oxidatief, fermentatief of niet -sacraal organisme.
Het medium van bevat een pepton/koolhydraatverhouding van 1: 5 in tegenstelling tot conventionele media van 2: 1. Dit garandeert dat de hoeveelheid alkalische amines gevormd uit de afbraak van peptonen de vorming van zwakke zuren niet neutraliseert.
Kan u dienen: Sphingomyeline: wat is, structuur, functies, syntheseAan de andere kant bevat het medium natriumchloride en dipotassiumfosfaat. Deze verbindingen stabiliseren osmotisch in het midden en reguleren de pH respectievelijk. Bromootimol Blue is de pH -indicator, waardoor de kleur van het gele groene met de productie van zuur wordt.
Sommige micro -organismen kunnen koolhydraten gebruiken door oxidatief of via de fermentatieve route, terwijl anderen niet op alle mogelijke manieren nemen.
Dit hangt af van het kenmerk van elke micro -organisme. Sommige strikte aerobe micro -organismen kunnen bijvoorbeeld bepaalde koolhydraten oxideren, en optionele anaëroben kunnen oxideren en fermeren, afhankelijk van de omgeving eromheen, terwijl anderen geen koolhydraten oxideren of fermenteren (ascarolitiek).
Ten slotte is er een aanpassing van het medium aanbevolen door de CDC die een speciale basis van met rode fenol als indicator bevat.
Oxidatieproces
Het glucose -oxidatieproces vereist geen glucosefosforylering, zoals voorkomt in het fermentatieproces. In dit geval wordt de aldehyde -groep geoxideerd tot een carboxylgroep, wat resulteert in gluconzuur. Dit wordt op zijn beurt geoxideerd tot 2-Zo-glyconic.
De laatste of twee pyruvinezuur moleculen accumuleren of degraderen. Dit systeem heeft de aanwezigheid van zuurstof of een anorganische verbinding nodig als laatste elektronenacceptor.
De productie van zuren door deze route is zwakker dan die verkregen door de fermentatieve route.
Gistingsproces
Om glucosefermentatie door een van de beschikbare wegen te maken, moet het eerst worden gefosforyleerd en glucose-6-fosfaat worden.
Glucosefermentatie kan verschillende wegen innemen, de belangrijkste is het pad van Embden-Meyerhof-Parna van de afbraak van pentose.
Het gekozen pad hangt af van het enzymatische systeem dat de micro -organisme bezit.
Via de Embden-Meyerhof-Parna
In de gisting van glucose door Embden-Meyerhof-Parna. Van daaruit komt een intermediaire substantie af, wat pyruvinezuur is.
Kan u van dienst zijn: fotoperiodeVan daaruit zullen verschillende soorten gemengde zuren worden gevormd die kunnen variëren van de ene soort tot de andere.
Dit systeem treedt op bij afwezigheid van zuurstof en heeft een organische verbinding nodig als laatste elektronenacceptor.
En enervoudoroff -route
In de fermentatie van glucose door de intner-Doucoroff-route gaat het glucose 6-fosfaat naar glucone-ᵼ-lacton-6-fosfaat en van daaruit wordt het geoxideerd tot 6-fosfogluvaat en 2-zo-3-dedexi-6 fosfogluconaat, om eindelijk pyruvinezuur te vormen. Dit via nodig zuurstof nodig zodat er glycolyse is.
Route voor de afbraak van de pentose of Warburg-Dikens monofosfaatmonofosfaat via
Deze route is een hybride van de vorige 2. Het begint vergelijkbaar met de entner-Doudoroff-route, maar vervolgens wordt glyceraldehyde-3-fosfaat gevormd als een pyruvinezuurvoorloper, zoals het geval is in het pad van Embden-Meyerhof-parna.
Voorbereiding
Wegen:
2 gr van pepton
5 gr van natriumchloride
10 gr van D-glucosa (of koolhydraat dat zal worden voorbereid)
0,03 gr van bromotimol blauw
3 gr van agar
0,30 gr van dipotasisch fosfaat
1 liter gedestilleerd water.
Meng alle verbindingen behalve koolhydraten en lost op in 1 liter gedestilleerd water. Verwarm en roer tot het oplost in zijn geheel.
Bij koeling bij 50 ° C wordt 100 ml glucose toegevoegd tot 10% (gefilterd).
Verdeel 5 ml van het medium van het medium van het medium van het deksel en autoclavaat bij 121 ° C, 15 pond druk gedurende 15 minuten.
Laat de verticale positie binnen.
De middelgrote pH moet 7, 1 zijn. De kleur van het voorbereide medium is groen.
In de koelkast houden.
Toepassingen
Het medium van is een speciaal middel om het metabolische gedrag van een micro -organisme tegen een koolhydraat te bepalen. Vooral voor degenen die zuren vormen van een schaarse, zwakke of nul manier.
Gezaaid
Voor elk micro -organisme zijn 2 buizen nodig, beide moeten worden geïnoculeerd met het micro -organisme om te studeren. De kolonie wordt genomen met een rechte handgreep en een punctie wordt gemaakt in het midden van de buis zonder de bodem te bereiken; U kunt verschillende lekke banden maken, zolang u niet geïnteresseerd bent in het observeren van motiliteit.
Kan u dienen: Alanine: kenmerken, structuur, functies, biosyntheseAan een van de buizen wordt een laag steriele vloeibare vaseline of steriele gesmolten paraffine toegevoegd (ongeveer 1 tot 2 ml) en is gelabeld met de letter "F". De andere buis wordt origineel achtergelaten en gelabeld met de letter "O". Beide buizen worden geïncubeerd bij 35 ° C en worden dagelijks waargenomen tot 3 tot 4 dagen.
Interpretatie
Gasmetabolisme en productie
Tabel: Classificatie van micro -organismen volgens hun gedrag in de open (oxidatieve) en gesloten (fermentatieve) buizen (fermentatief)
 Bron: gemaakt door de MSC -auteur. Marielsa Gil
Bron: gemaakt door de MSC -auteur. Marielsa Gil Het gas wordt waargenomen met de vorming van bubbels of verplaatsing van de agar.
Opgemerkt moet worden dat een organisme dat alleen glucose maar niet fermente oxideert, andere koolhydraten niet kan fermenteren, in elk geval zal het alleen oxideren. Daarom zal in deze situatie de verzegelde buis worden weggelaten voor de studie van andere koolhydraten.
Beweeglijkheid
Bovendien is in het midden van de motiliteit te zien.
Positieve motiliteit: Groei die niet beperkt is tot de inoculatiezone. Er is groei naar de zijkanten van de buis.
Negatieve motiliteit: Groei alleen in het eerste inoculum.
QA
Als kwaliteitscontroles kunt u de volgende stammen gebruiken: Escherichia coli, Pseudomonas aeruginosa En Moraxella SP. De verwachte resultaten zijn:
- coli: Glucosefermenter (zowel gele als gasbuizen).
- aeruginosa: Glucose -oxidader (gele open buis en groene of blauwe afdichting).
- Moraxella SP: Niet -verwijzing (groene of blauwe open buis, groene afdichtingsbuis).
Beperkingen
-Sommige micro -organismen kunnen niet groeien in de omgeving van. In deze gevallen wordt de test herhaald, maar voor het medium 2% serum of 0,1% gistextract.
-Oxidatiereacties worden vaak waargenomen dicht bij het oppervlak en de rest van het medium kan groen zijn, op dezelfde manier als positief wordt beschouwd.
Referenties
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Microbiologische diagnose. 5e ed. Pan -Amerikaanse redactionele s.NAAR. Argentinië.
- Forbes B, Sahm D, Weissfeld a. (2009). Bailey & Scott microbiologische diagnose. 12 ed. Pan -Amerikaanse redactionele s.NAAR. Argentinië.
- Mac Faddin J. (2003). Biochemische tests voor de identificatie van klinisch belang bacteriën. 3e ed. Pan -Amerikaans redactioneel. Buenos Aires. Argentinië.
- Laboratoria Francisco Soria Melguizo. 2009. Van glucosemedium. Beschikbaar op: http: // f-soria.is
- Conda pronadisa laboratoria. Midden van glucose. Beschikbaar bij: Condalab.com
- BD Laboratories. 2007. Van basaal medium. Beschikbaar op: BD.com

