Smozyme -kenmerken, structuur, functies
- 1188
- 200
- Nathan Wiegand
De Smozymen Het zijn hydrolytische enzymen die wijd verspreid zijn in de natuur die in staat zijn om de glucosidebindingen van peptidoglycan in de bacteriemuur te hydrolyseren. Ze zijn aanwezig in planten en dieren en functioneren als een afweermechanisme tegen bacteriële infecties.
De ontdekking van deze enzymen dateert uit 1922, toen Alexander Fleming zich realiseerde dat er een eiwit was dat de katalytische capaciteit van Lisar -bacteriën had in sommige weefsels en menselijke secreties.
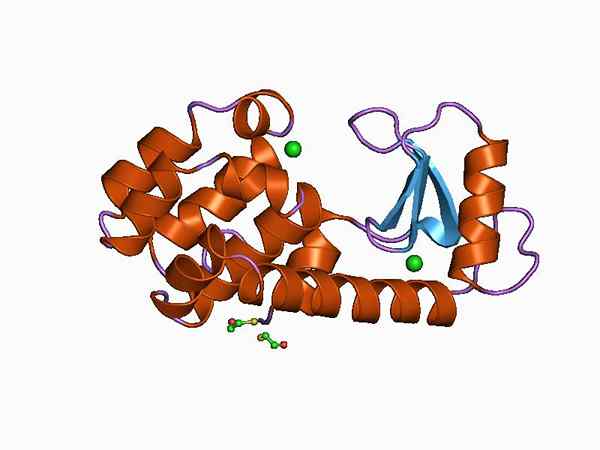
 Grafische weergave van de structuur van de gladheid (Bron: Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain] via Wikimedia Commons)
Grafische weergave van de structuur van de gladheid (Bron: Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain] via Wikimedia Commons) Dankzij zijn gemakkelijke verkrijgen en zijn kleine formaat, de lysozy. Het wordt momenteel gebruikt als modelsysteem in chemie, enzym, kristallografie en eiwitmoleculaire biologie.
Smozyme is een "bacteriolithisch" enzym dat gespecialiseerd is in de hydrolyse van β -1,4 glucosidische binding gram -positieve bacteriën.
Het heeft verschillende functies, zowel spijsvertering als immunologisch, in alle organismen waar het voor verschillende doeleinden wordt uitgedrukt en gebruikt als een biotechnologische hulpbron.
[TOC]
Kenmerken
De gladheid wordt uitgedrukt door de belangrijkste groepen levende organismen op de planeet, maar zijn bijzonder overvloedig bij dieren en het is van deze die zijn gezuiverd en meer bestudeerd.
Bij mensen bevindt het lyszym zich in hoge concentraties in verschillende vloeistoffen en weefsels zoals lever, kraakbeen, speeksel, slijm en tranen. Het wordt uitgedrukt door hematopoietische cellen en wordt ook gevonden in granulocyten, monocyten en macrofagen, evenals in andere voorlopercellen van het beenmerg.
Kan u van dienst zijn: ruw endoplasmatisch reticulumSmozymen van plantenoorsprong hydrolysubstraten vergelijkbaar met die welke worden gebruikt door andere nauw verwante enzymen die bekend staan als chitinasen, om deze reden kunnen ze ook bindingen in chitine hydrolyseren, hoewel met minder efficiëntie.
Soorten gladheid bij dieren en hun kenmerken
Ten minste drie soorten gladheid zijn beschreven in het dierenrijk:
-De gladde C ("C" van "Conventioneel "of"CHicken ", Wat betekent kip in het Engels)
-Het smozym g ("g" van "GOede”, Wat Goose in het Engels betekent) en
-De gladde Type I ("I" van "JeNvertebrates ”)
De drie klassen smoothies verschillen van elkaar met betrekking tot hun aminozuursequenties, hun biochemische kenmerken en hun enzymatische eigenschappen.
Blees Type C
Deze gladheid wordt beschouwd als de "model" -enzymen van deze familie, omdat ze hebben gediend als een model voor structuur- en functiestudies. Ze staan bekend als type "C" van Engels "Kuikens"Omdat ze voor het eerst werden geïsoleerd uit kippeneieren.
In deze klasse zijn de gladheid geproduceerd door de meeste gewervelde dieren, vooral door vogels en zoogdieren. Het omvat ook enzymen aanwezig in sommige geleedpotigen zoals Lepidoptera, Diptera, sommige arachniden en schaaldieren.
Het zijn kleine enzymen omdat ze een molecuulgewicht hebben dat niet groter is dan 15 kDa. Het zijn basische eiwitten met hoge iso -elektrische punten.
Blees Type G
De eerste gladheid van dit type werd geïdentificeerd in het ei.
In sommige gevallen zijn de Gy -type soepels overvloediger dan Type C -gladden in de eiwitten van bepaalde vogels, terwijl het tegenovergestelde optreedt, de gladde CS van Type C zijn overvloediger.
Kan u van dienst zijn: LenticelaDeze gladheid zijn ook aanwezig in tweekleppige weekdieren en enkele tunicaten. Ze zijn een beetje grotere eiwitten dan die van type C, maar hun molecuulgewicht is meestal niet groter dan 25 kDa.
Blees type I
Deze gladheid is voornamelijk aanwezig in ongewervelde dieren. De aanwezigheid ervan is bepaald in Anélidos, echinoderms, schaaldieren, insecten, weekdieren en nematoden, en is afwezig bij zoogdieren en andere gewervelde dieren.
Ze hebben meer zure iso -elektrische punten dan die van type C- en type G -eiwitten.
Structuur
De drie soorten dierlijke enzymen beschreven in de vorige sectie hebben vrij vergelijkbare drie -dimensionale structuren.
De gladheid van mensen is een glad type C en was de eerste van deze enzymen die worden bestudeerd en structureel gekarakteriseerd. Het is een klein eiwit van 130 aminozuurafval en wordt gecodeerd door een gen op chromosoom 12, dat 4 exons en 3 introns heeft.
De structuur is verdeeld in twee domeinen: een bekend als Domein α En een ander zoals β -domein. Het α -domein bestaat uit vier alfa -hallen en het β -domein gevormd door een antiparallela β -blad en een grote lus.
De katalytische plaats van het enzym is in de kloof die wordt gevormd tussen beide domeinen en voor de kruising met het substraat heeft verspilling van glutaminezuur en asparaginezuur. Bovendien heeft het minstens zes "subsitios" bekend als A, B, C, D, E en F, in staat om zes opeenvolgende verspilling van suikers aan te sluiten.
Functie
De soepelheid heeft niet alleen fysiologische functies in de bescherming en gevecht tegen bacteriële infecties in de organismen die het tot expressie brengen, maar, zoals is becommentarieerd, is het zeer nuttig geweest als een enzymmodel vanuit het chemische, enzymatische en structurele standpunt.
Kan je van dienst zijn: epitheelcellen plaveiselIn de huidige industrie wordt het erkend als een krachtig bactericide en wordt het gebruikt voor het behoud van voedsel en drugs.
Dankzij de reactie die deze enzymen katalyseren, kunnen ze op verschillende bacteriële populaties werken en de stabiliteit van hun wanden veranderen, die zich vervolgens vertaalt in cellysis.
In combinatie met andere soortgelijke enzymen kan gladheid werken op zowel gram -positieve bacteriën als op gram -negatieve bacteriën, zodat ze kunnen worden beschouwd als delen van het antibacteriële "immuun" -systeem van verschillende soorten organismen.
In de witte bloedcellen die aanwezig zijn in het bloed van zoogdieren, hebben deze enzymen belangrijke functies bij de afbraak van binnenvallende micro -organismen, dus ze zijn essentieel voor het immuunsysteem van mensen en andere zoogdieren.
Smozymen in planten vervullen in wezen dezelfde functies als bij de dieren die ze uitdrukken, omdat ze als een eerste verdedigingslinie zijn tegen bacteriële pathogenen.
Referenties
- Callewaert, l., & Michels, W. (2010). Lysozymen in het dierenrijk. J. Biosci., 35(1), 127-160.
- Merlini, g., & Bellotti, V. (2005). Lysozyme: een paradigmatisch molecuul voor het onderzoek naar eiwitstructuur, functie en misfolding. Clinic Chemical Act, 357, 168-172.
- Kijk. (1977). Lysozyme: een korte recensie. Postgraduate Medical Journal, 53, 257-259.
- Sahoo, n. R., Kumar, p., Bhusan, B., Bhattacharya, t. K., Dayal, s., & Sahoo, m. (2012). Lysozyme in vee: een gids voor selectie Forase. Journal of Animal Science Advances, 2(4), 347-360.
- Wohlkönig, a., Huet, J., Looze, en., & Wintjens, r. (2010). Structurele relaties in de Lysozyme -superfamilie: significant bewijs voor handtekeningmotieven van glycoside hydrolase. PLOS One, 5(11), 1-10.
- « Oyamel -functies, habitat en distributie, gebruik
- Nucleaire poriënkenmerken, functies, componenten »

