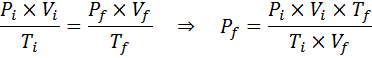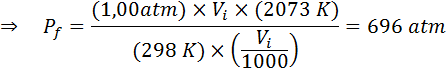Algemene gassenwet

- 1507
- 177
- Pete Heaney V
Wat is de algemene gaswetgeving?
De Algemene gassenwet, Soms ook wel de gecombineerde wet van gassen genoemd, het is de combinatie van Boyle's wetten, Charles en Gay-Lussac. Het is een wet die de relatie beschrijft tussen de druk, de temperatuur en het volume van een vaste hoeveelheid van een ideaal gas.
De verklaring van deze wet zegt:
“Als het aantal mol een gas constant is, blijft de relatie tussen het drukvolume en het temperatuurproduct constant."
In wiskundige vorm wordt de algemene wet van gassen als volgt uitgedrukt:
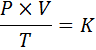
Waarbij p de druk van het gas vertegenwoordigt, v het volume, t de absolute temperatuur, en k is een evenredigheidsconstante, waarvan de waarde afhangt van zowel de hoeveelheid huidige gas als de eenheden waarin de andere variabelen worden uitgedrukt.
Alternatieve vormen van de algemene gaswetgeving
Als evenredigheidswet
Een alternatieve manier om de algemene wet van gassen uit te spreken, is in de vorm van een evenredigheidswet:
"Voor elke vaste hoeveelheid van een gas is het product van zijn druk en zijn volume recht evenredig met de temperatuur".
Dit betekent dat:
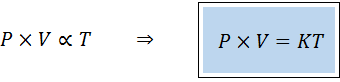
Dit is gelijk aan het vermenigvuldigen van beide leden van de eerste vergelijking door temperatuur.
Relatie tussen de eerste en laatste toestand
Net als de wetten van Boyle, Charles en Gay-Lussac, kan de algemene gaswet worden uitgedrukt als een relatie tussen de initiële staat en de uiteindelijke staat van een gas dat een staatsverandering ondergaat.
In tegenstelling tot de vorige wetten, is het niet nodig dat geen van de drie variabelen constant blijft, alleen het aantal mol. Dat wil zeggen dat de PXV/T -verhouding in de beginstatus hetzelfde zal zijn, Je, En in de laatste staat, F. Met andere woorden, de algemene gaswet kan ook wiskundig worden uitgedrukt als:
Het kan u van dienst zijn: Píchric Acid: wat is, structuur, synthese, eigenschappen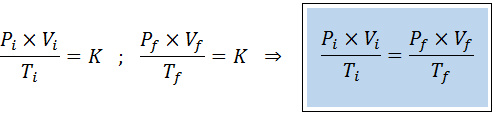
Afleiding van de formule van de algemene gaswetgeving
Zoals hierboven vermeld, komt de algemene gaswet uit de combinatie van de wetten van Boyle, Charles en Gay-Lussac. Deze wetten worden hieronder gepresenteerd:
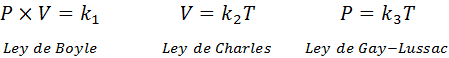
Als we uit elk van deze wetten de constante wissen k, En dan vermenigvuldigen we ze met elkaar, we krijgen:
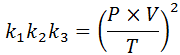
Nu, de vierkante wortel in beide leden, wordt de algemene gaswet verkregen:
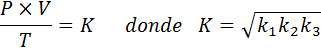
De algemene wet van gassen versus. De wet van de ideale gassen
De algemene gassenwet met de ideale gassenwet moet niet worden verward. Ondanks dat ze twee zeer vergelijkbare en ook nauw verwante wetten zijn, combineert de algemene gaswet alleen de wetten van Boyle, Charles en Gay-Lussac.
Van zijn kant voegt de ideale gassenwet het Avogadro -principe toe, volgens welke "Gelijke volumes van verschillende gassen gemeten onder dezelfde temperatuur- en drukomstandigheden, bevatten hetzelfde aantal deeltjes ”.
Als gevolg hiervan maakt de wet van ideaal gas, naast het relateren van de temperatuur, volume en druk, deze variabelen ook gerelateerd aan het aantal deeltjes of de mol Ideale gassen.
In de volgende vergelijkingen kan het verschil tussen deze twee wetten gemakkelijker worden waargenomen:

Merk op dat het belangrijkste verschil tussen beide wetten is dat de ideale gaswetgeving omvat N, die het aantal mol vertegenwoordigt, en ook in plaats van de constante K, heeft De constante r die de constante is van de ideale gassen.
Kan u van dienst zijn: TerpenosWe zouden kunnen zeggen dat de ideale gassenwet algemener is dan de algemene gaswet, omdat deze kan worden toegepast voor een hoeveelheid gas onder elke set druk-, temperatuur- en volumecondities. Aan de andere kant vereist de toepassing van de algemene gaswet dat de hoeveelheid gas constant blijft.
Voorbeelden van de toepassing van de algemene gaswetgeving
Hieronder staan enkele voorbeelden van typische problemen waarin de algemene gaswet kan worden toegepast:
Voorbeeld 1: een luchtbubbel onder water
Stel dat een duiker die zich op een diepte van 20 m onder water bevindt waar de druk 3,00 atm is en de temperatuur 15 ° C is, een ademhaling vrijgeeft en een van de bubbels een eerste volume van 100 cm heeft3.
Bepaal het volume van de luchtbel wanneer deze het oppervlak bereikt dat zich in standaardtemperatuur- en drukomstandigheden bevindt, ervan uitgaande dat de hoeveelheid lucht in de bel niet verandert als deze stijgt.
Oplossing
Ten eerste moeten we alle gegevens uit de verklaring halen. Het is wel verstaan dat er twee verschillende toestanden zijn voor gas, één eerste en één uiteinde, dus we scheiden de gegevens in twee groepen. Het is ook noodzakelijk om temperaturen bij absolute temperatuur om te zetten:

Aangezien het probleem aangeeft dat er geen verandering is in de hoeveelheid gas (de lucht), kunnen we de algemene gaswet toepassen, van waaruit we het uiteindelijke volume kunnen wissen:
Kan u van dienst zijn: Rodio: Geschiedenis, eigenschappen, structuur, gebruik, risico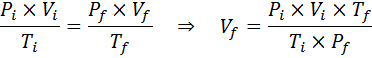
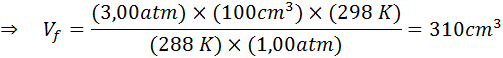
Daarom bereikt de luchtbel een volume van 310 cm3 Bij het bereiken van het oppervlak.
Voorbeeld 2: hoge druk
Hoeveel zal de druk van een ideaal gas dat zich bij een omgevingstemperatuur van 25 ° C bevindt en een druk van 1,00 atm en de duizendste van zijn volume comprimeren, op hetzelfde moment tot 1800 ° C in een afgesloten container verwarmt?
Oplossing
Zoals voorheen beginnen we met het extraheren van de gegevens:

Zoals staat dat het proces wordt uitgevoerd in een verzegelde container, verandert de hoeveelheid gas niet, zodat de algemene gaswet kan worden toegepast: