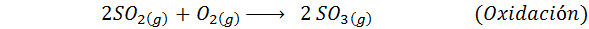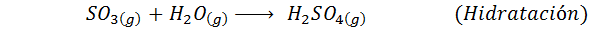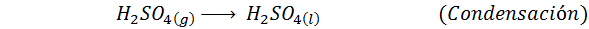Zwavelzuur (H2SO4)

- 5027
- 1563
- Cecil Graham
We leggen uit wat zwavelzuur, de chemische structuur, eigenschappen, hoe het wordt verkregen, toepassingen en gebruiksrisico's is
 Zwavelzuurboten (H2SO4)
Zwavelzuurboten (H2SO4) Wat is zwavelzuur?
Hij zwavelzuur, Ook wel waterstofsulfaat en vitriololie genoemd, het is een oxacid zwavelzuur gevormd door de zwavelanhydride -reactie (dus3) en water. De moleculaire formule is h2SW4 En het is verreweg het meest geproduceerde en gebruikte mineraalzuur.
Het is een sterk en zeer corrosief mineraalzuur dat mengbaar is met water, zodat het kan worden bereid in de vorm van oplossingen van bijna elke concentratie tussen 0 en ongeveer 18 molair.
De grote productievolumes en consumptie van deze verbinding zijn te wijten aan de meerdere toepassingen in de industrieën zo gevarieerd als landbouw, de petrochemische industrie, in organische en anorganische synthese en bij de behandeling van afvalwater, om slechts enkele te noemen slechts enkele.
Zwavelzuurstructuur
Zwavelzuur wordt gevormd door een centraal zwavelatoom met Valencia VI dat is omgeven door 4 zuurstofatomen, waarvan er twee zijn gekoppeld aan waterstofatomen. De Lewis -structuur wordt hieronder gepresenteerd:
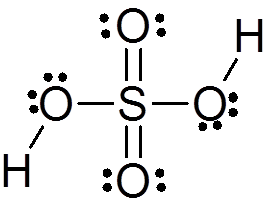
Zoals u kunt zien, wordt zwavel in deze verbinding omgeven door 12 elektronen (6 paren), dus het vertegenwoordigt een van de uitzonderingen van de octetregel.
Omringd door 4 atomen, voorspelt de theorie van afstoting van de elektronenparen van Valencia (Trepev) dat deze verbinding een ongeveer tetraëdrische geometrie moet aannemen, die in de volgende afbeelding wordt getoond:
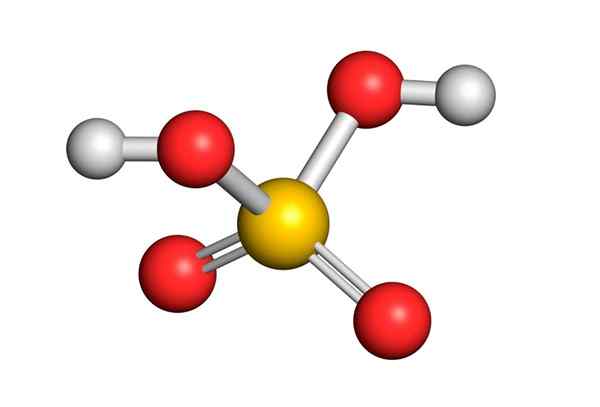
Vanwege de hoge elektronegativiteit van zuurstof en de verschillende resonantiestructuren die zwavelzuur kan hebben, zijn bindingen tussen zuurstof en hydrogenen sterk gepolariseerd, waardoor ze zeer zuur en gemakkelijk te dissociëren van hydrogenen.
Zwavelzuur eigenschappen
Als gevolg van zijn structuur heeft zwavelzuur de volgende fysische en chemische eigenschappen:
Het kan u van dienst zijn: Epoxide: nomenclatuur, verkrijgen, aanvragen, voorbeeldenFysieke eigenschappen
- Puur zwavelzuur is een kleurloze en toiletvloeistof met een dichtheid van 1.8302 g/ml.
- Het smeltpunt is 10,31 ° C en het koken is 337 ° C, hoewel het bij die temperatuur de neiging heeft om water en zwavelanhydride te produceren (ook wel zwaveltrioxide genoemd).
- Het is volledig mengbaar met water, dus u kunt oplossingen voorbereiden met elke concentratie. Oplossingen met meer dan 98,3% in massa van dit zuur zijn echter onstabiel en afbreekt aan zuur totdat de concentratie afneemt tot 98,3%. Deze oplossing is stabiel en staat bekend als geconcentreerd zwavelzuur.
- In zijn zuivere of geconcentreerde toestand is het een meer viskeuze vloeistof dan water.
Chemische eigenschappen
- Puur zwavelzuur is een sterk oxidatiemiddel en corrosieve stof. Het heeft het vermogen om te oxideren, uit te dringen en sulfonar tot een breed scala aan organische verbindingen en anderen te carboniseren.
- Het is een sterk diprotisch zuur dat zijn eerste proton volledig verliest door op te lossen in water en zo zijn geconjugeerde basis te worden, het bisulfaat -ion (HSO4-)). Dit ion is ook een zuur, hoewel zwakker dan het oorspronkelijke zuur.
- Waterige zwavelzuuroplossingen zijn sterk zuur en zijn in staat om veel metalen op te lossen, waardoor gasvormige waterstof wordt gegenereerd. Ze zijn ook in staat om sterke bases volledig te neutraliseren.
- Reageert heftig met veel alcoholen en water, waardoor grote hoeveelheden warmte worden vrijgeeft in het proces.
Hoe wordt zwavelzuur verkregen?
De drie bekendste productieprocessen voor zwavelzuur zijn: het contactproces, het natte zwavelzuurproces en het proces van loodcamera's.
1. Zwavelzuursynthese door het contactproces
Dit is vandaag de meest gebruikte methode om zwavelzuur te produceren. Het proces bestaat uit 5 stappen waarin elementaire zwavel zwaveldioxide wordt (dus2), dan zwaveltrioxide (dus3), disulfurinezuur (h2S2OF7) en ten slotte in zwavelzuur. De betrokken reacties zijn:
Kan u van dienst zijn: wat is de beveiligingsrhombus en waar is het voor?
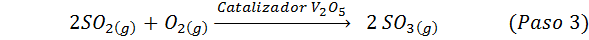


De tweede stap van het proces bestaat eenvoudig uit de zuivering van zwaveldioxide voordat het wordt omgezet in zwavel- of zwavelanhydride -trioxide. De reactie van de derde stap treedt op wanneer het gasvormige zwaveldioxide in contact komt met een vaste vanadium pentaoxidekatalysator (V2OF5), En daarom wordt de methode het contactproces genoemd.
2. Zwavelzuursynthese door het natte proces
Dit proces is ontworpen om de emissiegassen van een grote verscheidenheid aan chemische industrieën en planten te zuiveren. Het bijproduct van deze zuivering is commerciële kwaliteit zwavelzuur naast warmwaterdamp, die kan worden hergebruikt in het oorspronkelijke industriële proces.
In het geval van het natte proces zijn de reacties meestal. De belangrijke reacties die in elke fase optreden, zijn:
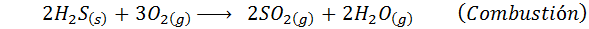
3. Zwavelzuursynthese door het proces van loodcamera's
Dit is een oude methode om zwavelzuur te produceren die tegenwoordig heel weinig wordt gebruikt. Het proces was om elementaire zwavel te verbranden in aanwezigheid van luchtzuurstof in houten kamers met loodcoated.
Na deze verbranding reageert zwaveldioxide vervolgens met stikstofoxiden geproduceerd door de ontleding van natriumnitraat of op andere middelen. Uiteindelijk werd na een reeks extra reacties verkregen, zwavelzuur.
Kan u van dienst zijn: vlakke achtergrondflesVeel voorkomende toepassingen
- De belangrijkste toepassing van zwavelzuur is als een bron van zwavel in de vorm van sulfaten bij de vervaardiging van meststoffen. In feite is ongeveer 60% van de in de wereld geproduceerde zwavelzuur bedoeld voor dit doel.
- In de chemische industrie wordt het gebruikt voor de synthese van wasmiddelen, pigmenten, katalysatoren voor de petrochemische industrie en bij de verwerking van mineralen om verschillende metalen te verkrijgen.
- Ten slotte is zwavelzuur de elektrolyt die wordt gebruikt in de loodbatterijen die in de meeste auto's worden gebruikt.
Risico's geassocieerd met zwavelzuur
Vanwege zijn chemische eigenschappen kan zwavelzuur zeer gevaarlijk zijn voor zowel mensen als dieren en het milieu in het algemeen. Dit zijn enkele van de risico's die aan deze chemische stof zijn verbonden:
- De corrosieve en dehydraterende kenmerken maken puur zuur grote schade als het in contact komt met de huid.
- Aan de andere kant genereert de reactie van waterige oplossingen van zwavelzuur met metalen gasvormige waterstof, wat een brandstof en explosieve stof is.
- Zwavelzuur zelf heeft geen verbrandingsreactie, maar stimuleert een sterk oxidatiemiddel de verbranding van andere stoffen, die als een soort katalysator fungeert, dus het vertegenwoordigt een aanzienlijk brandrisico.
- Bovendien kan het wanneer blootgesteld aan vuur worden onderverdeeld in giftige gassen en zwavelzuurdampen genereren die de luchtwegen gemakkelijk kunnen vernietigen.
Om deze redenen en meer is zwavelzuur een stof die zorgvuldig moet worden afgehandeld.