Wet van ideale gassenformule en eenheden, toepassingen, voorbeelden

- 3217
- 983
- Cecil Graham
De Ideale gassenwet Het is een staatsvergelijking die een relatie beschrijft tussen de staatsfuncties die verband houden met het ideale gas; zoals temperatuur, druk, volume en moedervlekken. Deze wet maakt het mogelijk om echte gasvormige systemen te bestuderen die ze vergelijken met hun geïdealiseerde versies.
Een ideaal gas is een theoretisch gas, samengesteld uit specifieke of sferische deeltjes die willekeurig bewegen; Met grote kinetische energie, waarbij de enige interactie tussen hen volledig elastische botsingen is. Bovendien voldoen ze aan de ideale gaswetgeving.
 De ideale gaswet maakt het onderzoek en begrip van veel echte gasvormige systemen mogelijk. Bron: Pxhere.
De ideale gaswet maakt het onderzoek en begrip van veel echte gasvormige systemen mogelijk. Bron: Pxhere. Bij standaarddruk en temperatuur (STP): 1 atm druk en een temperatuur van 0 ºC, gedragen de meeste echte gassen zich kwalitatief als ideale gassen; op voorwaarde dat hun dichtheden laag zijn. Grote intermoleculaire of interatomische afstanden (voor edelgassen) vergemakkelijken dergelijke benaderingen.
Onder STP -omstandigheden zuurstof, stikstof, waterstof, edelgassen en sommige samengestelde gassen, zoals koolstofdioxide, gedragen zich als een ideaal gas.
Het ideale gasmodel heeft de neiging om te falen bij lage temperaturen, hoge drukken en dichtheden met hoge deeltjes; Wanneer intermoleculaire interacties, evenals de grootte van de deeltjes, belangrijk worden.
De ideale gassenwet is een samenstelling van drie gasewetten: de wet van Boyle en Mariotte, de wet van Charles en Gay-Lussac en de wet van Avogadro.
[TOC]
Formule en eenheden

De wet van gassen wordt wiskundig uitgedrukt met de formule:
PV = NRT
Waarbij p de druk is die wordt uitgeoefend door een gas. Het wordt meestal uitgedrukt met de atmosfeer -eenheid (ATM), hoewel het in andere eenheden kan worden uitgedrukt: MMHG, Pascal, Bar, enz.
Volume V bezet door gas wordt meestal uitgedrukt met eenheid van de liter (L). Terwijl N Het is het aantal mol, r de universele constante van gassen, en de temperatuur uitgedrukt in Kelvin (K).
De meest gebruikte expressie in R -gassen is gelijk aan 0,08206 L · atm · K-1· Mol-1. Hoewel de eenheid voor de gasconstante een waarde heeft van 8.3145 J · mol-1· K-1. Beide zijn geldig zolang ze voorzichtig zijn met de eenheden van de andere variabelen (P, T en V).
De ideale gassenwet is een combinatie van de wet van Boyle-Maleotte, de wet van Charles-Gay-Lussac en de wet van Avogadro.
Law Boyle-Maleotte
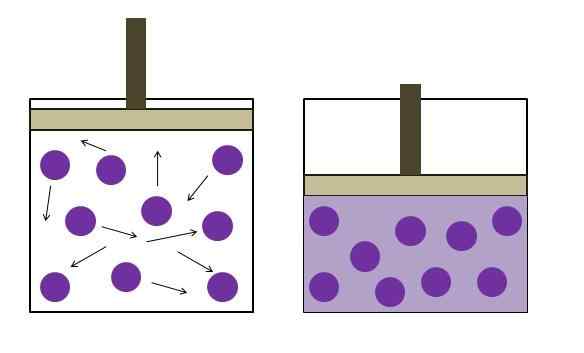 Verhoogde drukreductiedruk. Bron: Gabriel Bolívar
Verhoogde drukreductiedruk. Bron: Gabriel Bolívar Het werd onafhankelijk geformuleerd door natuurkundige Robert Boyle (1662) en de fysieke en botanicus Edme Mariotte (1676). De wet wordt als volgt vermeld: bij een constante temperatuur is het volume van een vaste massa van een gas omgekeerd evenredig met de druk die het uitoefent.
Kan u van dienst zijn: TerpenosPV ∝ K
Door twee punten te gebruiken:
P1V1 = P2V2
Charles-Gay-Lussac Law
 Chinese lantaarns of wensen. Bron: Pxhere.
Chinese lantaarns of wensen. Bron: Pxhere. De wet werd gepubliceerd door Gay-Lussac in 1803, maar verwezen naar het werk dat niet is gepubliceerd door Jacques Charles (1787). Om deze reden staat de wet bekend als de wet van Charles.
De wet stelt vast dat er bij constante druk een directe verhouding van evenredigheid is tussen het volume bezet door een gas en de temperatuur.
V ∝ k2T
Door twee punten te gebruiken:
V1/T1 = V2/T2
V1T2 = V2T1
Avogadro Law
De wet werd vermeld door Amadeo Avogadro in 1811, en merkte op dat gelijke volumes van alle gassen, bij dezelfde druk en temperatuur, hetzelfde aantal moleculen hebben.
V1/N1 = V2/N2
Wat de ideale gassenwet vestigt?
Door de ideale gassenwet wordt een relatie tussen vier onafhankelijke fysische eigenschappen van gas vastgesteld: de druk, volume, temperatuur en de hoeveelheid gas. Het is voldoende om de waarde van drie van hen te weten, om die van de resterende te verkrijgen.
De wet stelt de voorwaarden vast die aangeven wanneer een gas zich idealiter gedraagt, en wanneer het weggaat van dit gedrag.
De SO -aangedekte compressiefactor (PV/NRT) heeft bijvoorbeeld een waarde van 1 voor ideale gassen. Een waarde van de waarde van 1 voor de compressiefactor, geeft aan dat gasgedrag verloopt van het ideale gas.
Daarom zou een fout worden gemaakt bij het toepassen van de ideale gassenvergelijking op een gas dat zich niet volgens het model gedraagt.
Toepassingen
Berekening van dichtheid en molaire massa van een gas
De vergelijking van de ideale gaswet kan worden gebruikt bij de berekening van de dichtheid van een gas en zijn molaire massa. Bij het maken van een eenvoudige aanpassing kunt u een wiskundige uitdrukking vinden die de dichtheid (d) van een gas en zijn molaire massa (m) relateert:
D = MP/RT
En malend m:
M = DRT/P
Berekening van het volume van een gas geproduceerd in een chemische reactie
Stoichiometrie is de tak van de chemie die de hoeveelheid van de aanwezige reagentia relateert met de producten die betrokken zijn bij een chemische reactie, meestal tot expressie gebracht in mollen.
Het gebruik van de ideale gassenvergelijking maakt de bepaling van het volume van een gas dat in een chemische reactie wordt geproduceerd, bepaalt; Omdat u uit de chemische reactie het aantal mol kunt verkrijgen. Vervolgens kan het volume van het gas worden berekend:
Kan u van dienst zijn: glasionomeer: voorbereiding, eigenschappen, typen, gebruikPV = NRT
V = nrt/p
Het meten van V kan de prestaties of voortgang van de genoemde reactie bepalen. Als er geen gassen meer zijn, is het een indicatie dat reagentia volledig zijn uitgeput.
Berekening van gedeeltelijke druk van de gassen die aanwezig zijn in een mengsel
De ideale gassenwet kan worden gebruikt, samen met de gedeeltelijke drukwet van de Dalton, om de gedeeltelijke drukken van de verschillende gassen in een gasmengsel te berekenen.
De relatie wordt toegepast:
P = NRT/V
Om de druk van elk van de gassen in het mengsel te vinden.
Volume gas verzameld in water
Er wordt een reactie gemaakt die een gas produceert, dat wordt verzameld door een experimenteel ontwerp in water. Totale gasdruk is bekend plus waterdampdruk. De waarde van deze laatste kan worden verkregen in een tabel en door aftrekking kan de gasdruk worden berekend.
Uit de stoichiometrie van de chemische reactie kan het aantal mol van het gas worden verkregen en de relatie toepassen:
V = nrt/p
Het volume van het geproduceerde gas wordt berekend.
Voorbeelden van berekeningen
Oefening 1
Een gas heeft een dichtheid van 0,0847 g/l tot 17 ºC en een druk van 760 torr. Wat is je molaire massa? Wat is het gas?
We beginnen bij de vergelijking
M = DRT/P
We converteren eerst de temperatuureenheden naar Kelvin:
T = 17 ºC + 273.15 K = 290.15 K
En de druk van 760 Torr komt overeen met die van 1 atm. Nu hoeft u alleen de waarden te vervangen en op te lossen:
M = (0,0847 g/l) (0,08206 l · atm · k-1· Mol-1) (290.15 K) / 1 ATM
M = 2,016 g/mol
Deze molaire massa kan overeenkomen met een enkele soort: het diatomic waterstofmolecuul, h2.
Oefening 2
Een massa van 0,00553 g kwik (Hg) in een gasfase is in een volume van 520 L en bij een temperatuur van 507 K. Bereken de druk die wordt uitgeoefend door de Hg. De molaire massa van de Hg is 200,59 g/mol.
Het probleem wordt opgelost door de vergelijking te gebruiken:
PV = NRT
Informatie over het aantal mol Hg verschijnt niet; Maar ze kunnen worden verkregen door hun molaire massa te gebruiken:
Mol Hg = (0,00553 g Hg) (1 mol Hg/200,59 g)
Kan u van dienst zijn: zuurstof: eigenschappen, structuur, risico's, gebruik= 2.757 · 10-5 Mol
Nu moeten we gewoon p wissen en de waarden vervangen:
P = NRT/V
= (2.757 · 10-5 mol) (8,206 · 10-2 L · ATM · K-1· Mol-1) (507 K)/ 520 L
= 2.2 · 10-6 Geldautomaat
Oefening 3
Bereken de druk die wordt gegenereerd door zoutzuur geproduceerd door te reageren van 4,8 g chloorgas (CL2) met waterstofgas (h2), In een volume van 5,25 L, en bij een temperatuur van 310 K. De molaire massa van de Cl2 is 70,9 g/mol.
H2 g) + Klet2 g) → 2 HCl(G)
Het probleem wordt opgelost door de ideale gassenvergelijking te gebruiken. Maar de hoeveelheid HCl wordt uitgedrukt in gram en niet in mol, dus de gepaste transformatie wordt gemaakt.
Mol HCl = (4,8 g Cl2) (1 mol Cl2/70,9 g Cl2) (2 mol HCl/1mol Cl2))
= 0,135 mol HCl
De vergelijking van de ideale gassenwet toepassen:
PV = NRT
P = NRT/V
= (0,135 mol HCl) (0,08206 L · atm · K-1· Mol-1) (310 K) / 5,25 l
= 0,65 atm
Oefening 4
Een monster van 0,130 g van een gasvormige verbinding beslaat een volume van 140 ml bij een temperatuur van 70 ºC en bij een druk van 720 torr. Wat is je molaire massa?
Om de ideale gasevergelijking toe te passen, moeten verschillende wijzigingen eerst aanbrengen:
V = (140 ml) (1 l/1000 ml)
= 0,14 L
Met het volume in liters, moet u nu de temperatuur uiten in Kelvin:
T = 70 ºC + 273.15 K = 243.15 K
En ten slotte moeten we druk omzetten in atmosfeer -eenheden:
P = (720 torr) (1 atm/760 torr)
= 0,947 atm
De eerste stap bij het oplossen van het probleem is om het aantal mol te verkrijgen uit de verbinding. Hiervoor wordt de vergelijking van de ideale gassen gebruikt en we hebben gewist N:
PV = NRT
N = PV / RT
= (0,947 atm) (0,14 L) / (0,08206 l · atm · k-1· Mol-1) (243.15 K)
= 0,067 mol
Het is alleen nodig om het molaire deeg te berekenen door de gram te delen tussen de verkregen mol:
Molaire massa = gram van de verbinding / aantal mol.
= 0,130 g / 0,067 mol
= 19,49 g/mol
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Iran. Levine. (2014). Principes van fysicochemie. Zesde editie. MC Graw Hill.
- Glasstone. (1970). Fysisch chemie verdrag. Tweede druk. Machtig.
- Mathews, c. K., Van Holde, K. EN., En ahern, k. G. (2002). Biochemie. 3was Editie. Pearson Addison Wesley redactioneel.
- Wikipedia. (2019). Ideaal gas. Opgehaald uit: in.Wikipedia.borg
- Redactie. (2018). Law of Boyle-Maleotte Law | Gaswetten. Hersteld van: iquimicas.com
- Jessie A. Sleutel. (S.F.)). De ideale gaswet- en subtoepassingen. Opgehaald uit: OpenTextbc.AC
- « Saoedi -Arabië cultuurtradities, gebruiken, gastronomie
- Productief circuit van de hoofdfasen van het vlees »

