Boyle Law
- 1013
- 229
- Nathan Wiegand
Wat is de wet van Boyle?
De wet van Law Boyle of Boyle-Maleotte Het is er een die de relatie uitdrukt tussen de druk die wordt uitgeoefend door of op een gas, en het volume dat dit bezet; constant zowel de gastemperatuur als de hoeveelheid (aantal mol) behouden.
Deze wet beschrijft samen met die van Charles, Gay-Lussac, Charles en Avogadro het gedrag van een ideaal gas; In het bijzonder, in een gesloten container, onder voorbehoud van volumeveranderingen die door een mechanische kracht worden uitgeoefend.
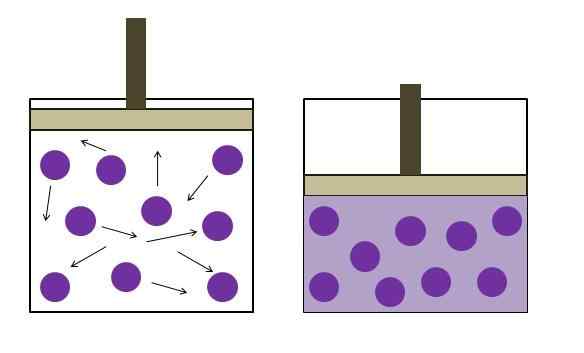
 Verhoogde drukreductiedruk. Bron: Gabriel Bolívar
Verhoogde drukreductiedruk. Bron: Gabriel Bolívar De bovenste afbeelding vat de wet van Boyle kort samen. Paarse punten vertegenwoordigen moleculen of gasatomen, die botsen met de interne wanden van de container (links). Door de beschikbare ruimte of volume van de container bezet door dit gas te verminderen, worden botsingen verhoogd, wat zich vertaalt in een toename van de druk (rechts).
Dit laat zien dat de P en Volume V -druk van het gas omgekeerd evenredig zijn als de container strak is gesloten; Anders zou een grotere druk gelijk zijn aan een grotere verwijding van de container.
Als een grafiek V tegen P, met de gegevens van V en P op respectievelijk de assen en en X, zou worden waargenomen, zou een asymptotische curve worden waargenomen. Hoe lagere V, hoe groter de toename van P; Dat wil zeggen, de curve zal zich uitstrekken naar hoge waarden van P op de X -as.
Natuurlijk blijft de temperatuur constant; Maar als hetzelfde experiment bij verschillende temperaturen zou worden uitgevoerd, zouden de relatieve posities van deze curven v vs P veranderen op de Cartesiaanse as. De verandering zou nog duidelijker zijn als het grafieken waren op een drie -dimensionale as, met constante t op de z -as.
Geschiedenis van de wet van Boyle
Achtergrond
Omdat de wetenschapper Galileo Galilei zijn geloof uitte in het bestaan van de leegte (1638), begonnen wetenschappers de eigenschappen van lucht en gedeeltelijke gaten te bestuderen.
De Angloirland -chemicus, Robert Boyle, begon zijn studie van luchteigenschappen in 1638 toen hij hoorde dat Otto von Guerchke, een Duitse ingenieur en fysieke ingenieur, een luchtbom had gebouwd.
Kan u bedienen: Bromine: geschiedenis, structuur, elektronische configuratie, eigenschappen, gebruikKwikexperiment
Om zijn luchtdrukstudies uit te voeren, gebruikte Boyle een "J" -vormige buis, wiens constructie werd toegeschreven aan Robert Hooke, een Boyle -assistent. Het korte armuiteinde was verzegeld, terwijl het uiteinde van de lange arm open was om het kwik te plaatsen.
Vanaf het begin wilde Boyle de elasticiteit van lucht bestuderen, kwalitatief en kwantitatief. Toen Mercurius door het open uiteinde van de buis stroomde in de vorm van "J", leidde Boyle af dat de lucht in de korte arm van de buis werd gecontracteerd onder de druk van kwik.
Resultaat
Hoe groter de hoeveelheid kwik die aan de buis is toegevoegd, hoe groter de druk die op de lucht werd uitgeoefend en hoe lager het volume is. Boyle verkreeg een negatief exponentiële grafiek van het luchtvolume, afhankelijk van de druk.
Ondertussen, als het volume van de lucht tegen de omgekeerde druk wordt uitgezet, is er een rechte lijn van positieve helling.
In 1662 publiceerde Boyle de eerste fysieke wet die werd gegeven in de vorm van een vergelijking, die de functionele afhankelijkheid van twee variabelen aangaf. In dit geval druk en volume.
Boyle zei dat er een omgekeerde relatie was tussen de druk die op een gas werd uitgeoefend en het volume bezette dat gas, deze relatief echte relatie voor echte gassen zijn. De meeste gassen gedragen zich als ideale gassen tot matige druk en temperaturen.
Wanneer hogere drukken en lagere temperaturen optreden, werden afwijkingen van het gedrag van de echte gassen van de idealen opmerkelijker.
Edme mariotte
De Franse natuurkundige Edme Mariotte (1620-1684) ontdekte onafhankelijk dezelfde wet in 1679. Maar hij had de verdienste om aan te tonen dat het volume varieert met de temperatuur. Daarom wordt het de wet van Mariotte of de wet van Boyle en Mariotte genoemd.
Versterking van de wet
Daniel Bernoulli (1737) versterkte de wet van Boyle door erop te wijzen dat de druk van een gas wordt geproduceerd door de effecten van gasdeeltjes op de wanden van de container die het bevatten.
Het kan u van dienst zijn: nucleofiel: nucleofiele aanval, types, voorbeelden, nucleofiliciteitIn 1845 publiceerde John Waterston een wetenschappelijk artikel, dat zich richt op de belangrijkste principes van de kinetische theorie van gassen.
Vervolgens consolideerden Rudolf Clausius, James Maxwell en Ludqwig Boltzmann de kinetische theorie van gassen, die de druk relert die wordt uitgeoefend door een gas met de snelheid van gasdeeltjes in beweging in beweging in beweging.
Hoe lager het volume van de container die een gas bevat, hoe groter de frequentie van de effecten van de deeltjes die deze vormen tegen de wanden van de container; En daarom, hoe groter de druk die door het gas wordt uitgeoefend.
Wat is deze wet?
De experimenten die door Boyle zijn uitgevoerd, wijzen erop dat er een omgekeerde relatie bestaat tussen het volume bezet door een gas en de druk die erop wordt uitgeoefend. De bovengenoemde relatie is echter niet volledig lineair, zoals aangegeven door een volumevariatiegrafiek volgens de druk toegeschreven aan Boyle.
In de wet van Boyle wordt aangegeven dat het volume bezet door een gas omgekeerd evenredig is met de druk. Het wordt ook aangegeven dat het product van de druk van een gas door zijn volume constant is.
Wiskundige expressie
Om de wiskundige uitdrukking van de wet van Boyle te bereiken, begint het van:
V ∝ 1/P
Waar het aangeeft dat het volume dat door een gas wordt bezet, omgekeerd evenredig is met zijn druk. Er is echter een constante die bepaalt hoe omgekeerd evenredig deze relatie is.
V = k/p
Waarbij k de evenredigheidsconstante is. Clearing k heb je:
VP = K
Het product van de druk van een gas door zijn volume is constant. Dus:
V1P1 = K en V2P2 = K
En dit kan worden afgeleid dat:
V1P1 = V2P2
De laatste is de uitdrukking of uiteindelijke vergelijking voor de wet van Boyle.
Waar is het voor? Welke problemen lost de wet van Boyle op?
Stoommachines
De wet van Boyle-Maleotte wordt toegepast bij de werking van stoommachines. Het is een externe verbrandingsmotor die de transformatie van de thermische energie van een hoeveelheid water in mechanische energie gebruikt.
Water wordt verwarmd in een strak gesloten ketel en de geproduceerde stoom oefent druk uit volgens de Boyle -wet die een uitbreiding van een cilindervolume produceert door een zuiger te duwen.
Kan u van dienst zijn: verdunningsfactorDe lineaire beweging van de zuiger wordt omgezet in een rotatiebeweging, met behulp van een cranks en crank -systeem, dat de wielen van een locomotief of de rotor van een elektrische generator kan aandrijven.
Dranken
De actie van het aspireren van een frisdrank of een sap van een fles door een plastic buis is gerelateerd aan de wet van Boyle. Wanneer de lucht van de buis wordt voorgesteld met behulp van de mond, is er een afname van de druk in de buis.
Deze drukval vergemakkelijkt de oplopende beweging van de vloeistof in de buis, waardoor zijn inname mogelijk is. Ditzelfde principe werkt in bloedextractie met behulp van een spuit.
Ademhalingssysteem
De wet van Boyle is nauw verwant aan het functioneren van het ademhalingssysteem. Tijdens de inspiratiefase vindt de samentrekking van het diafragma en andere spieren plaats; Externe intercostalen bijvoorbeeld die een uitbreiding van de ribbenkast produceren.
Dit veroorzaakt een afname van de intrapleurale druk, waardoor een longuitbreiding wordt veroorzaakt die een toename van de longvolume veroorzaakt. Daarom neemt de intrapulmonale druk af volgens wat er wordt verhoogd in de wet van Boyle.
Door subatose te worden de intrapulmonale druk, stroomt atmosferische lucht in de longen, die een toename van de druk in de longen produceert; dus het matchen van de druk op de atmosferische druk en het afsluiten van de inspiratiefase.
Vervolgens ontspannen inspiratoire spieren en de expiratoire spieren contracteren. Bovendien wordt elastische pulmonale retractie geproduceerd, een fenomeen dat een afname van het longvolume produceert, met een daaruit voortvloeiende toename van intrapulmonale druk, verklaarbaar door de wet van Boyle.
Door de intrapulmonale druk te verhogen en groter te worden dan atmosferische druk, stroomt lucht in de longen naar de atmosfeer. Dit gebeurt totdat de druk gelijk is aan, die de vervalfase afsluit.
Referenties
- De wet van Boyle. Encyclopædia Britannica. Hersteld van: Britannica.com
- De formule voor de wet van Boyle. Hersteld van: Thoughtco.com

