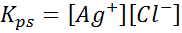Massa -actiewetgeving

- 2923
- 504
- Miss Herman Russel
 Een neerslagreactie omvat het evenwicht van de oplosbaarheid, die wordt beheerst door de massa -actiewetgeving
Een neerslagreactie omvat het evenwicht van de oplosbaarheid, die wordt beheerst door de massa -actiewetgeving Wat is de massale actiewetgeving?
De Massa -actiewetgeving stelt dat de snelheid van een reactie afhangt van de concentratie van zijn reactanten die zijn verhoogd tot zijn stoichiometrische coëfficiënten. Deze wet maakt het mogelijk om de concentraties in de balans van de reactanten en producten van een omkeerbare chemische reactie met elkaar met elkaar te verhouden. Met andere woorden, het stelt de formule van de evenwichtsconstante vast.
De massale actiewet werd uitgewerkt door de Noorse (en crème) chemici cato m m. Guldberg (1836-1902) en Peter Wagon (1833-1900) in 1864. Dit is een van de fundamentele wetten van de chemie, omdat het ons in staat stelt om de uiteindelijke concentraties in evenwicht te berekenen van de initiële hoeveelheden.
Daarnaast stelt de massawet ons ook in staat om gemakkelijk de effecten van veranderingen in de concentraties van een van de soorten in balans te begrijpen. Met andere woorden, het stelt ons in staat om te begrijpen hoe de principes van Le Chatlier werken.
Ondanks dat het "massale actiewet" wordt genoemd, verwijst het niet echt naar de massa van de reactanten en producten, maar eerder naar hun concentraties. De reden die massa -actiewetgeving wordt genoemd en niet de wet van actie van concentraties is omdat de concentratie "actieve massa" wordt genoemd.
De massale actiewetgeving en de evenwichtsconstante
Volgens de massa -actiewetgeving, wanneer omkeerbare reacties het evenwicht bereikt, is dit niet omdat de reactie stopt. Integendeel, de balans wordt bereikt wanneer de snelheid van de directe reactie gelijk wordt gedaan aan de snelheid van de inverse reactie. Wanneer dat gebeurt, komen alle chemische soorten voor en worden ze met dezelfde snelheid geconsumeerd, zodat hun concentraties constant worden (ze stoppen met veranderen).
Kan u van dienst zijn: tolueen: structuur, eigenschappen, gebruik, verkrijgenGuldberg en Wagement ontdekten dat de snelheden van beide reacties (de directe en de inverse) afhankelijk zijn van de molaire concentratie (in mol/L) van hun reagentia die zijn verheven tot de stoichiometrische coëfficiënten. Uit deze observaties slaagden ze erin om de formule voor de evenwichtsconstante te vinden.
Volgens deze wet, voor elke omkeerbare chemische reactie die evenwicht bereikt,
“... De relatie tussen het product van de molaire concentraties van de producten die zijn verhoogd tot hun stoichiometrische coëfficiënten en het product van de molaire concentraties van de reactanten die zijn verhoogd tot hun stoichiometrische coëfficiënten is constant bij een bepaalde temperatuur."
Deze constante wordt "evenwichtsconstante" genoemd en wordt weergegeven met het k -symboolC.
De evenwichtsconstante formule
Laten we eens kijken hoe de vorige verklaring eruit ziet in de vorm van een wiskundige vergelijking. Het is een omkeerbare chemische reactie zoals die hieronder gepresenteerd, waarbij A en B de reactanten zijn, C en D de producten en A, B, C en D zijn de respectieve stoichiometrische coëfficiënten van de gebalanceerde reactie:
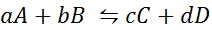
Voor een generieke reactie als deze wordt de evenwichtsconstante gegeven door:
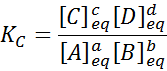
waar [a], [b], [c] en [d] de molaire concentraties van A, B, C en D in balans zijn.
De balansconstante in druk
De vorige formule voor de evenwichtsconstante is van toepassing op elke chemische reactie waarin alle stoffen zich in dezelfde fase bevinden (dat wil zeggen dat ze allemaal in waterige fase zijn, of bijvoorbeeld in een gasfase). In het geval van gasfasreacties is het echter handiger om met druk te werken dan met concentraties.
Aangezien de molaire concentratie van gassen evenredig is met hun partiële druk, kan de formule van de evenwichtsconstante als volgt worden herschreven in termen van deze druk:
Het kan u van dienst zijn: 30 gebruik van carbonzuren in het dagelijks leven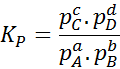
Waar PNAAR, PB, PC En PD Ze zijn de gedeeltelijke druk van respectievelijk A, B, C en D, en A, B, C en D blijven de stoichiometrische coëfficiënten. In dit geval kP Het wordt de constante balans in druk genoemd en is gerelateerd aan kC Door de volgende formule:
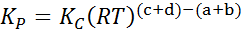
waarbij r de universele constante van ideale gassen is en t de absolute temperatuur is in Kelvin.
Reacties met meer dan één fase
Soms omvat een chemische reactie de vorming van een vaste stof als een neerslag uit een oplossing, of de vorming van een vloeistof van reactanten die reageren in een gasfase. In deze gevallen vindt de reactie niet plaats in dezelfde fase, dus moeten we de evenwichtsconstante formule wijzigen.
Gelukkig zijn wijzigingen heel eenvoudig. Het enige waar we rekening mee moeten houden bij het schrijven van de formule van de evenwichtsconstante is dat de zuivere stoffen die als vaste stoffen of vloeistoffen verschijnen, niet in aanmerking moeten houden. In plaats daarvan plaatsen we in plaats daarvan een 1.
Concluderend, de massa -actiewetgeving maakt het mogelijk om de formule van de evenwichtsconstante zowel in concentraties als in gedeeltelijke druk te schrijven. Bij het kennen van een van de twee kan de andere van de eerste worden gevonden.
Ten slotte moeten we voorzichtig zijn en de fase bekijken waarin alle chemische soorten worden gevonden, om te weten of we ze al dan niet in de evenwichtsconstante moeten opnemen.
Voorbeelden van het gebruik van de massa -actiewetgeving
In de volgende voorbeelden laten we zien hoe we de massa -actiewet kunnen gebruiken om de formules van evenwichtsconstanten te schrijven voor verschillende soorten chemische reacties.
Reacties van reacties in gasvormige toestand
Voorbeeld 1: de ontleding van n2OF4 in een gasfase
Dan2OF4 Het is een bruin gas dat afbreekt volgens de volgende reactie:
Het kan u van dienst zijn: láuriczuur: structuur, eigenschappen, gebruik, voordelen, effecten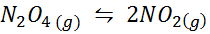
 NO2 -monster bij verschillende temperaturen die de verplaatsing van evenwicht naar de bruine N2O4 tonen
NO2 -monster bij verschillende temperaturen die de verplaatsing van evenwicht naar de bruine N2O4 tonen Voor deze reactie worden de evenwichtsconstanten in concentraties en druk gegeven door:
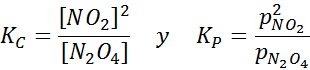
Voorbeeld 2: de oxidatie van koolmonoxide
Koolmonoxide is een zeer giftig gas dat koolstofdioxide kan worden bij het reageren met zuurstof volgens de volgende reactie:
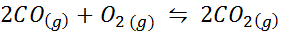
Voor deze reactie worden de evenwichtsconstanten in concentraties en druk gegeven door:
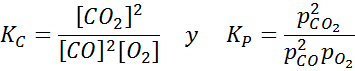
Zuur-base saldi in waterige fase
Voorbeeld 3: water zelflengte
De ionenbalans van water, ook bekend als de reactie van het water zelflengte, is een omkeerbare reactie tussen twee watermoleculen in een vloeibare toestand. De reactie is:
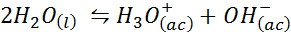
Bij het schrijven van de evenwichtsconstante voor deze reactie moeten we rekening houden dat in dit geval het enige reagens een pure vloeistof is waarvan de concentratie praktisch constant is. Om deze reden is het niet opgenomen in de formule van de evenwichtsconstante:
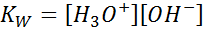
Dit is een zeer belangrijke evenwichtsconstante die zijn eigen naam ontvangt (constante van het ionische product van water) en zijn eigen symbool (kW. W verwijst naar water in het Engels, dat wordt gezegd toilet)). Het is echter een evenwichtsconstante in concentraties zoals elke andere.
Oplosbaarheidsbalansen
Voorbeeld 4: Silver Chloride Solubility Balance
Wanneer we een verzadigde oplossing voorbereiden, wordt een oplosbaarheidsbalans vastgesteld. In dit geval is het evenwicht dat van de oplossing van het zilveren chloride, waarvan de reactie wordt gegeven door:
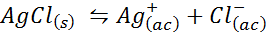
De evenwichtsconstante van deze reactie (en van alle oplossingsreacties) omvat geen zilverchloride (AGCL) omdat het een vaste stof is. Bovendien ontvangen deze constanten, net als in het geval van water, ook een speciale naam die "constant van het oplosbaarheidsproduct" is, weergegeven als k$: