Formele belasting
- 3922
- 331
- Dewey Powlowski
Wat is de formele belasting?
De Formele belasting (Cf) is er een die is toegewezen aan een atoom van een molecuul of ion, waardoor de structuren en chemische eigenschappen kunnen worden uitgelegd, afhankelijk van dit. Dit concept impliceert de overweging van het maximale karakter van covalentie in de A-B-link; dat wil zeggen, het paar elektronen wordt gelijk gedeeld tussen A en B.
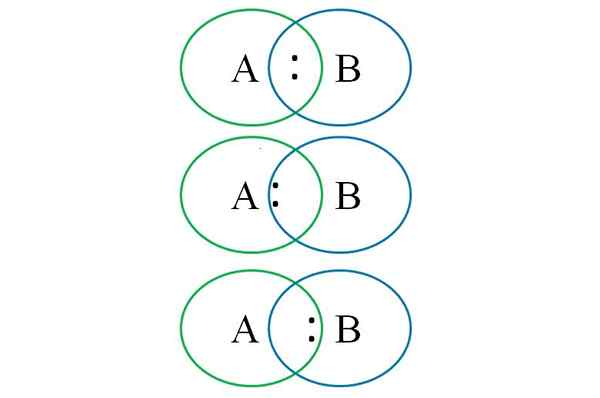
Om het bovenstaande in de onderste afbeelding te begrijpen, worden twee gekoppelde atomen getoond: een aangewezen met letter A en de andere met letter B. Zoals te zien is, wordt in het onderscheppen van cirkels een link met het paar gevormd ":". In dit heteronucleaire molecuul, als A en B gelijke elektronegativiteiten hebben, blijft het koppel ":" blijft zowel A als B op gelijke afstand.

Gezien het feit dat twee verschillende atomen echter geen identieke eigenschappen kunnen hebben, wordt het paar ":" aangetrokken waaraan het meer elektronegatief is. In dit geval, als A elektronegatiefer is dan B, is het paar ":" dichter bij dat van B. Het tegenovergestelde treedt op wanneer B meer elektronegatief is dan A, nu nadert ":" A B.
Om vervolgens formele ladingen zowel A als B toe te wijzen, is het noodzakelijk om het eerste geval te overwegen (die boven de afbeelding). Als de puur covalente link A-B brak, zou er een homolitieke breuk optreden, waardoor vrije radicalen worden gegenereerd A · en · B.
Kwalitatieve voordelen van het gebruik van formele belasting
De elektronen zijn niet vast, zoals in het vorige voorbeeld, maar ze reizen en gaan verloren door de atomen van het molecuul of ion. Als het een diatomee molecuul is, is het bekend dat het paar ":" moet worden gedeeld of ronddwalen tussen beide atomen; Hetzelfde gebeurt in een molecuul van type A-B-C, maar met een grotere complexiteit.
Wanneer een atoom echter wordt bestudeerd en een honderd procent covalentie in zijn banden veronderstelt, is het gemakkelijker om vast te stellen of binnen de samengestelde overwinningen of verliest elektronen. Om deze winst of verlies te bepalen, moet uw basale of vrije toestand worden vergeleken met uw elektronische omgeving.
Kan u van dienst zijn: Amagat Law: uitleg, voorbeelden, oefeningenOp deze manier is het mogelijk om een positieve belasting (+) toe te wijzen als het atoom een elektron verliest, of een negatieve belasting (-) wanneer een elektron daarentegen wint (de borden moeten in een cirkel worden geschreven).
Hoewel de elektronen niet exact kunnen worden gevonden, worden deze formele belastingen (+) en (-) in de structuren in de meeste gevallen aangepast aan de verwachte chemische eigenschappen.
Dat wil zeggen, de formele belasting van een atoom is nauw verwant aan de moleculaire geometrie van zijn omgeving en reactiviteit in de verbinding.
Formule en hoe deze te berekenen
Zijn formele belastingen willekeurig toegewezen? Het antwoord is nee. Hiervoor moet de winst of verlies van elektronen worden berekend door puur covalente bindingen aan te nemen, en dit wordt bereikt door de volgende formule:
CF = (Atom Group Number) - (Aantal links die vorm geven) - (aantal uitgepakte elektronen)
Als het atoom een CF heeft met een waarde van +1, wordt een positieve belasting ( +) toegewezen; Terwijl als je een CF hebt met een waarde van -1, deze vervolgens een negatieve belasting wordt toegewezen ( -).
Om de CF correct te berekenen, moeten de stappen hieronder worden gevolgd:
- Zoek welke groep het atoom in het periodiek systeem.
- Tel het aantal links dat vormt met hun buren: de dubbele links (=) zijn twee waard en de drievoudige links zijn drie waard (≡).
- Ten slotte, het tellen van het aantal niet gedeeld elektronen, dat gemakkelijk kan worden waargenomen met Lewis -structuren.
Berekeningsvariaties volgens de structuur
Gezien het lineaire molecuul A-B-D-D, kunnen formele belastingen voor elk atoom variëren als de structuur bijvoorbeeld nu is geschreven als: B-C-A-D, C-A-B-D, A-C-D-B, enz. Dit komt omdat er atomen zijn die, door meer elektronen te delen (meer bindingen vormen), positieve of negatieve CF verwerven.
Het kan u van dienst zijn: Meniscus (chemie)Dus welke van de drie mogelijke moleculaire structuren komt overeen met de ABCD -verbinding? Het antwoord is: degene die over het algemeen de laagste CF -waarden bezit; Ook degene die negatieve belastingen (-) toewijst aan de meest elektronegatieve atomen.
Als C en D meer elektronegatief zijn dan A en B, dan door meer elektronen te delen, verwerven ze bijgevolg positieve formele belastingen (gezien uit een mnemonische regel).
De meest stabiele structuur, en de meest voorkeur van de energie, is dus C-A-B-D, omdat ze in zowel C als B slechts één link vormen. Aan de andere kant zijn de structuur A-B-C-D en die met een C of B die twee links vormen (-c- of -d-), meer onstabiel.
Welke van alle structuren is het meest onstabiel? A-C-D-B, omdat niet alleen C en D twee links vormen, maar ook hun negatieve formele belastingen (-) grenzen aan elkaar, waardoor de structuur verder destabiliseert.
Voorbeelden van formele belastingberekeningen
BF4- (Tetrluoroborato ion)
Het booratoom wordt omgeven door vier fluoratomen. Aangezien de B tot groep IIIA (13) behoort, mist geen gedeelde elektronen en vormt vier covalente bindingen, de CF is (3-4-0 = -1). In plaats daarvan voor het F, element van groep VIIA (17), is de CF (7-6-1 = 0).
Om de belasting van het ion of molecuul te bepalen, is het voldoende om de afzonderlijke CF's van de atomen toe te voegen die het samenstellen: (1 (-1) + 4 (0) = -1).
De CF voor B heeft echter geen echte betekenis; Dit is, hierover woont niet de grootste elektronische dichtheid. Eigenlijk wordt deze elektronische dichtheid verdeeld over de vier F -atomen, veel meer elektronegatief element dan B.
Kan u van dienst zijn: zwak zuurBeh2 (berylliumhydride)
Het Beryllium -atoom behoort tot groep IIA (2), vormt twee links en ontbreekt, nogmaals, van niet gedeelde elektronen. Dus de CF voor de BE en de H zijn:
CFZijn= 2-2-0 = 0
CFH= 1-1-0 = 0
Beh -lading2= 1 (0) + 2 (0) = 0
CO (koolmonoxide)
De Lewis -structuur kan worden weergegeven als: C≡O: (hoewel het andere resonantiestructuren presenteert). Door de berekening van de CF te herhalen, dit keer voor de C (van de btw -groep) en de O (van de VIA -groep), hebt u:
CFC= 4-3-2 = -1
CFOF= 6-3-2 = +1
Dit is een voorbeeld waarbij formele ladingen niet passen bij de aard van de elementen. De of is meer elektronegatief dan de C en zou daarom geen positief moeten dragen.
De andere structuren (C = O en (+CO(-)), hoewel ze voldoen aan de coherente toewijzing van de belastingen, nalaten ze niet aan de octetregel (de C heeft minder dan acht elektronen van Valencia).
NH4+ (Ion ammonium), NH3 en NH2- (amiduro ion)
Hoe meer elektronen de N delen, hoe positiever zijn CF (naar het ammoniumion, omdat het geen energiebeschikbaarheid heeft om vijf bindingen te vormen).
Ook de berekeningen voor het N -ammonium, de ammoniak en het amiduro -ion toepassen, hebben dan:
CF = 5-4-0 = +1 (NH4+))
CF = 5-3-2 = 0 (NH3))
En tenslotte:
CF = 5-2-4 = -1 (NH2-))
Dat wil zeggen in de NH2- De N heeft vier niet gedeeld elektronen en delen alles wanneer het de NH vormt4+. CF voor H is gelijk aan 0 en daarom is uw berekening opgeslagen.

