Leucineigenschappen, structuur, functies, biosynthese
- 3897
- 368
- Dewey Powlowski
De Leuf Het is een van de 22 aminozuren die de eiwitten van levende organismen vormen. Dit behoort tot een van de 9 essentiële aminozuren die niet door het lichaam worden gesynthetiseerd en moeten worden geconsumeerd met voedsel dat in het dieet is ingenomen.
Leucina werd voor het eerst beschreven in 1818 door de Franse apotheker en chemicus. Lot. Proust, die het 'oxide-caseous' noemde. Later bereidden Erlenmeyer en Kunlin het uit van a-benzoilamido-β-isopropilacrylzuur, waarvan de moleculaire formule C6H13NO2NO2 is.
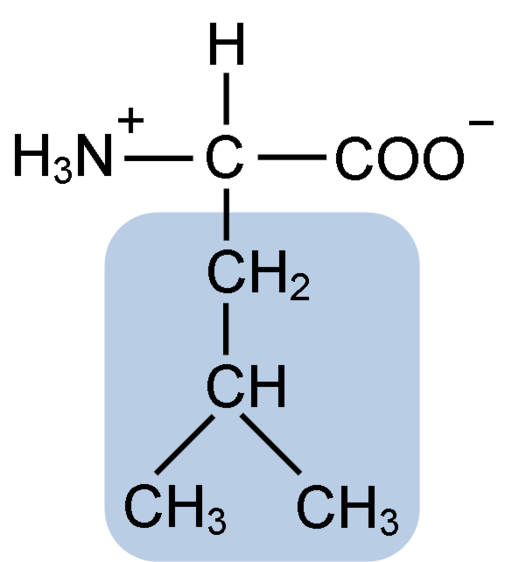
 Chemische structuur van het leucine-aminozuur (fuene: clavecin [cc by-sa 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Chemische structuur van het leucine-aminozuur (fuene: clavecin [cc by-sa 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) Leucine was cruciaal tijdens de ontdekking van het gevoel van eiwittranslatie, omdat de hydrofobe structuur de biochemist Howard Dentzis toestond om radioactief de waterstof van koolstof 3 te markeren en de betekenis te observeren waarin aminozuren worden opgenomen in de peptidesynthese van hemoglobine.
De eiwitten die bekend staan als "rits" of "sluitingen" van Leucina zijn, samen met de "zinkvingers", de belangrijkste transcriptiefactoren van eukaryotische organismen. Leucine -ritsen worden gekenmerkt door hun hydrofobe interacties met DNA.
Over het algemeen worden de eiwitten die rijk zijn aan leucine of gevormd door vertakte aminozuren niet gemetaboliseerd in de lever, in plaats daarvan gaan ze rechtstreeks naar de spieren waar ze snel worden gebruikt voor eiwitsynthese en het verkrijgen van energie.
Leucine is een aminozuur van vertakte ketting die nodig is voor de biosynthese van de eiwitten en aminozuren van melk, die worden gesynthetiseerd in de borstklieren. U kunt grote hoeveelheden van dit vrije aminozuur vinden in moedermelk.
Onder alle aminozuren die eiwitten vormen, zijn leucine en arginine de meest voorkomende en zijn beide gedetecteerd in de eiwitten van alle koninkrijken die de boom van het leven vormen.
[TOC]
Kenmerken
Leucine staat bekend als het essentiële aminozuur van vertakte ketting, het deelt de typische structuur met de andere aminozuren. Het wordt echter onderscheiden omdat de zijketen of R -groep twee koolstofatomen heeft gekoppeld en de laatste is gekoppeld aan een waterstofatoom en twee methylgroepen.
Het behoort tot de groep polaire aminozuren zonder belasting, de substituenten of R -groepen van deze aminozuren zijn hydrofobe en niet -polaire aard. Deze aminozuren zijn de belangrijkste verantwoordelijk voor intra-proteic hydrofobe interacties en hebben de neiging de structuur van eiwitten te stabiliseren.
Alle aminozuren, met een centrale koolstof die chirale is (koolstof α), dat wil zeggen, het heeft vier verschillende verenigde substituenten, ze kunnen op twee verschillende manieren in de natuur worden gevonden; Er zijn dus D- en L-Leucina, de laatste typisch in eiwitstructuren.
Beide vormen van elk aminozuur hebben verschillende eigenschappen, nemen deel aan verschillende metabole routes en kunnen zelfs de kenmerken van de structuren wijzigen waarvan ze deel uitmaken.
Leucine in L-Leucina heeft bijvoorbeeld een enigszins bittere smaak, terwijl het in zijn d-leucine-vorm erg zoet is.
De vorm van elk aminozuur is gemakkelijker te metaboliseren door het lichaam van zoogdieren. L-Leucina wordt gemakkelijk afgebroken en geëxploiteerd voor de constructie en bescherming van eiwitten.
Structuur
Leucine bestaat uit 6 koolstofatomen. De centrale koolstof, gebruikelijk in alle aminozuren, is gekoppeld aan een carboxylgroep (COOH), een aminogroep (NH2), een waterstofatoom (H) en een zijketen of R R -groep bestaande uit 4 koolstofatomen.
Kan u van dienst zijn: MesothelioKoolstofatomen in aminozuren kunnen worden geïdentificeerd met Griekse letters. De nummering begint van de carbonzuur (COOH) koolstof, terwijl de annotatie met het Griekse alfabet begint vanuit de centrale koolstof.
Leucine heeft als een substituerende groep in zijn R-keten R tot een isobutyl- of 2-methylpropilgroep die wordt geproduceerd door het verlies van een waterstofatoom, met de vorming van een alkylradicaal; Deze groepen verschijnen als gevolgen in de aminozuurstructuur.
Functie
Leucine is een aminozuur dat kan dienen als ketogene voorloper van andere verbindingen die betrokken zijn bij de citroenzuurcyclus. Dit aminozuur vertegenwoordigt een belangrijke bron voor de synthese van acetyl-CoA of acetoacetyl-CoA, die deel uitmaken van de vormingsroutes van de ketonlichamen in levercellen.
Het is bekend dat leucine onmisbaar is in insulinesignaleringsroutes, die deelnemen aan het begin van de eiwitsynthese en het verlies van eiwitten als gevolg van afbraak vermijdt.
Gewoonlijk zijn de interne structuren van eiwitten samengesteld uit hydrofobe aminozuren zoals leucin, valine, isoleucine en methodine. Dergelijke structuren worden meestal geconserveerd voor gemeenschappelijke enzymen bij levende organismen, zoals in het geval van cytochroom c.
Leucine kan metabole routes in borstkliercellen activeren om lactose -synthese, lipiden en eiwitten te stimuleren die functies vervullen, zoals signaleringsmoleculen bij de regulatie van de energiehomeostase van de jongeren in zoogdieren.
Leucinerijke domeinen zijn een essentieel onderdeel van specifieke DNA -bindende eiwitten, die over het algemeen structurele diameters zijn op een super ingeschreven manier en die bekend staan als "leucine ritsjiteiwitten".
Deze eiwitten hebben als een onderscheidend kenmerk een regelmatig patroon van herhaalde leucines samen met andere hydrofobe aminozuren die verantwoordelijk zijn voor het reguleren van de vakbonden van transcriptiefactoren naar DNA en tussen verschillende transcriptiefactoren.
Leucin zip-eiwitten kunnen homo-of heterodimeren vormen die ze toestaan.
Biosynthese
Alle vertakte ketenaminozuren, inclusief leucine, worden voornamelijk gesynthetiseerd in planten en bacteriën. In bloeiende planten is er een significante toename van de productie van leucines, omdat het een belangrijke voorloper is voor alle verbindingen die verantwoordelijk zijn voor het aroma van bloemen en fruit.
Een van de factoren die worden toegeschreven aan de grote overvloed aan leucine in de verschillende bacteriële peptiden is dat 6 verschillende codons van de genetische code coderen voor leucine (UUA-uug-ucu-cuc-cuc-cua-cug), hetzelfde is ook waar voor arginine.
Leucine wordt gesynthetiseerd in bacteriën vanaf een route van vijf stappen die als uitgangspunt een ketacide gebruikt die verband houdt met de valine.
Dit proces wordt uit allosterisch gereguleerd, zodat wanneer er een overmaat leucine in de cellulaire is, het de enzymen remt die deelnemen aan de route en de synthese stopt.
Kan u van dienst zijn: Simpson Index: Formule, Interpretation en VoorbeeldBiosinthetische route
The biosynthesis of leucine in bacteria begins with the conversion of a derivative ketacid of the valine, the 3-methyl-2-oxobutanoat in (2s) -2-isopropilmalate, thanks to the action of the enzyme 2-isopropilmalto synta, which Use acetyl -Coa en water voor dat doel.
Het (2S) -2-isopropilmalaatverlies verliest een watermolecuul en wordt omgezet in 2-isopropilmaleaat door 3-isopropylmalaat dehydratase. Vervolgens voegt hetzelfde enzym een ander watermolecuul toe en transformeert de 2-isopropilmaleato in (2r-3s) -3-isopropilm.
De laatste verbinding wordt onderworpen aan een oxidorreductiereactie die de deelname van een NAD+-molecuul verdient, die de (2S) -2-isopropil-3-oxosuccinatie produceert, wat mogelijk is met de deelname van het enzym 3- isopropilmalato delebrogenase.
De (2S) -2-osopropyl-3-oxosuccinatie verliest een koolstofatoom in de vorm van CO2 spontaan, het genereren van het 4-methyl-2-oxopentanaat dat, door werking van een transaminase van vertakte kettingaminozuren (transaminase leucine, speciaal))) En met de gelijktijdige bevrijding van L-glutamaat en 2-oxoglutaraat produceert het L-Leucina.
Degradatie
De belangrijkste rol van leucine is om te werken als een signalering die de cel vertelt dat er voldoende aminozuren en energie zijn om de synthese van spiereiwitten te beginnen.
De afbraak van vertakte ketenaminozuren als leucine begint met een transaminatie. Dit en de twee daaropvolgende enzymatische stappen worden gekatalyseerd door de drie enzymen in het geval van leucine, isoleucine en valine.
De transaminatie van de drie aminozuren produceert de a-ecotoacidische derivaten hiervan, die onderhevig zijn aan een oxidatieve decarboxylering om acyl-Coa thioés te produceren die α zijn, β-dishydrogeneerd om thioés de acil-coa α, β β te produceren, β β β β, β-doorzitten.
Tijdens leucinekatabolisme, de overeenkomstige acyl-CoA-ontdekking, β-doorverzadigde β-in-in-inata (HMG-CoA), die intermediair is in cholesterolbiosynthese en andere isoprenoïden.
Katabole route van Leucina
Uit de vorming van de acyl-CoA oom α, β-doorverzadigde die voortkomt uit de leucine de katabole routes van dit aminozuur en de valine en de isoleucine wijken aanzienlijk uiteen.
De acyl-CoA ucion α, β-doorverzadigde leucina wordt stroomafwaarts verwerkt door drie verschillende enzymen die bekend staan als (1) 3-methylcrotonyl-CoA carboxylase, (2) 3-methylglutaconil-coa hydratasa en (3) 3-hydroxi-3-methylglutarili -Coa liasa.
In bacteriën zijn deze enzymen verantwoordelijk voor de omzetting van 3-methylcrotonyl-CoA (leucinerivaat) in 3-methylglutaconil-CoA, in 3-hydroxy-3-methylglutaril-coa en in acetoacetaat en acetyl-coa, respectievelijk.
De leucine die beschikbaar is in het bloed wordt benut voor de synthese van spier/myofibrillaire eiwitten (MP's). Dit fungeert als een activerende factor van dit proces. Werk ook rechtstreeks in op insuline, waardoor de levering van de
Leucine Rich Foods
De consumptie van rijke aminozuureiwitten is onmisbaar voor de cellulaire fysiologie van levende organismen en leucine is geen uitzondering bij essentiële aminozuren.
Eiwitten verkregen uit zuivelserum worden beschouwd als de rijkste in L-Leucina-residuen. Alle voedingsmiddelen met een hoog eiwitgehalte, zoals vis, kip, ei en rood vlees, bieden echter grote hoeveelheden leucine voor het lichaam.
Kan u van dienst zijn: reproductie van virussen: fasen en kenmerkenDe maïs in graan is slecht in lysine- en tryptofaanaminozuren, het heeft zeer rigide tertiaire structuren voor de spijsvertering en heeft weinig waarde vanuit voedingsoogpunt, maar het heeft een hoge niveaus van leucine en isoleucine.
De vruchten van peulvruchtplanten zijn rijk aan bijna alle essentiële aminozuren: lysine, treonine, isoleucine, leucine, fenylalanine en valine, maar hebben weinig gehalte aan methodine en cysteïne.
Leucine wordt geëxtraheerd, gezuiverd en geconcentreerd in tabletten als voedingssupplementen voor hoge concurrentieatleten en wordt op de markt gebracht als een medicijn. De belangrijkste bron voor het isolement van dit aminozuur komt overeen met de soja -sojameel.
Er is een voedingssupplement dat door atleten wordt gebruikt voor spierregeneratie die bekend staat als BCAA (Engels "Vertakte ketting aminozuur ")). Dit biedt hoge concentraties van vertakte ketenaminozuren: leucina, valina en isoleucine.
Voordelen van uw inname
Leucine rijke voedingsmiddelen helpen obesitas en andere metabole ziekten te beheersen. Veel voedingsdeskundigen wijzen erop dat voedingsmiddelen die rijk zijn aan leucine- en voedingssupplementen op basis van dit aminozuur bijdragen aan de regulering van eetlust en angst bij volwassenen.
Alle leucin -rijke eiwitten stimuleren spiereiwitsynthese; Er is aangetoond dat een toename van het aandeel van ingenomen leucine ten opzichte van de andere essentiële aminozuren de verzwakking van eiwitsynthese in het spierstelsel van ouderen kan omkeren.
Zelfs mensen met ernstige maculaire aandoeningen die verlamd zijn, kunnen het verlies van massa en spierkracht stoppen met de juiste orale leucinesuppletie, naast het toepassen van systemische spierweerstand.
Leucine, valine en isoleucine zijn essentiële componenten van de massa die de skeletspier van gewervelde dieren vormt, dus hun aanwezigheid is van vitaal belang voor de synthese van nieuwe eiwitten of voor de reparatie van de pre -bestaande.
Deficiëntiestoornissen
De tekortkomingen of misvormingen van het a-zo-stoat dehydrogenase-complex, dat verantwoordelijk is voor het metaboliseren van leucine, valine en isoleucine bij mensen, kunnen ernstige psychische stoornissen veroorzaken.
Bovendien is er een pathologische aandoening gerelateerd aan het metabolisme van deze vertakte ketenaminozuren die "urineziekte met arce siroopgeur" worden genoemd, genaamd ".
Tot op heden is het bestaan van nadelige effecten op overmatig leucineconsumptie niet aangetoond. Een maximale dosis van 550 mg/kg per dag wordt echter aanbevolen, omdat er geen langetermijnstudies zijn geweest met betrekking tot overmatige blootstelling aan weefsels aan genoemde aminozuur.
Referenties
- Álava, m. D. C., Camacho, m. EN., & Delgadillo, j. (2012). Spiergezondheid en preventie van sarcopenie: het effect van eiwit, leucin en ß-hydroxy-ß-methylbutiraat. Bone and Mineral Metabolism Magazine, 10(2), 98-102.
- Fenheme, of. R. (1993). Voedsel scheikunde (Nee. 664: 543). Hoger beroep.
- Massey, l. K., Sokatch, J. R., & Conrad, r. S. (1976). Vertakte keten amininozuur katabolisme in bacteriën. Bacteriologische beoordelingen, 40(1), 42.
- Mathews, c. K., & Ahern, k. G. (2002). Biochemie. Pearson Education.
- Alleen een. (1999). Leucinesuppletie en intensieve training. Sportgeneeskunde, 27(6), 347-358.
- Munro, h. N. (ED.)). (2012). Zoogdier eiwitmetabolisme (Vol. 4). Elsevier
- Nelson, D. L., Lehninger, een. L., & Cox, m. M. (2008). Lehninger -principes van biochemie. Macmillan.

