Isopentano -structuur, eigenschappen, gebruik, verkrijgen
- 2381
- 505
- Ernesto McKenzie
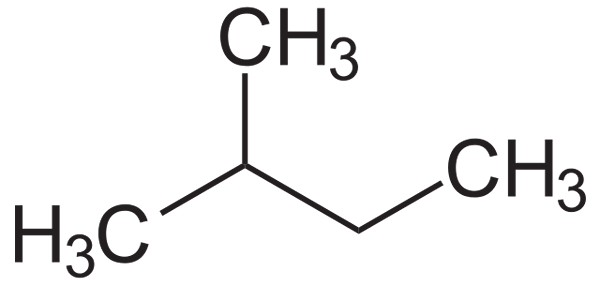
Hij Isopentano Het is een organische verbinding waarvan de gecondenseerde formule is (ch3))2Chch2Ch3. Het is een alkaan, met name een vertakt isomeer van de pentan, gekenmerkt door een zeer vluchtige vloeistof en gebruikt als een sprankelend middel. Momenteel is de meest aanbevolen naam van de IUPAC de 2-methylbutaan.
In het lagere beeld is de structurele formule te zien. Merk op dat een groep CH3 effectief is het gekoppeld aan koolstof 2 van de Butyl -keten. Van de isopentano wordt de isopentil of isopentil radicaal verkregen, een van de meest omvangrijke alquilicale substituenten die kunnen zijn.
 Structurele formule van de isopentano. Bron: Neurotoger / Public Domain
Structurele formule van de isopentano. Bron: Neurotoger / Public Domain De isopentano is een apolaire, hydrofobe en ontvlambare verbinding. De geur is vergelijkbaar met die van benzine en maakt deel uit van zijn samenstelling, omdat het zijn octaan- of octaannummer verhoogt. Het wordt verkregen uit de isomerisatiereactie van de N-Pentano, hoewel het natuurlijk in enkele hoeveelheden wordt bereikt in de aardgasreserves.
Afgezien van zijn zeer ontvlambare karakter, wordt de isopentano beschouwd als een niet -toxische stof. Een persoon kan het innemen en ruiken met mate voordat ze ongewenste symptomen presenteren, zoals verlangen om te braken en duizeligheid. De isopentano is te vinden in scheermescrèmes en haarconditioners.
[TOC]
Isopentano -structuur
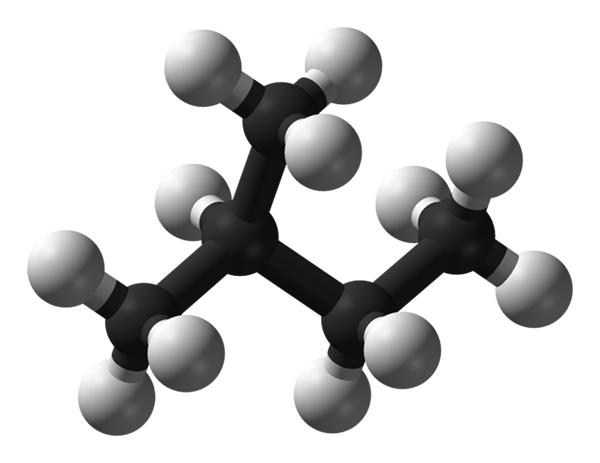 Isopentano moleculaire structuur. Bron: Benjah-bmm27 via Wikipedia.
Isopentano moleculaire structuur. Bron: Benjah-bmm27 via Wikipedia. In het superieure beeld hebben we de moleculaire structuur van de isopentano, voorgesteld door een model van bollen en bars. De zwarte bollen komen overeen met koolstofatomen, terwijl de witte bollen tot waterstofatoom. Van het koolzuurhoudende skelet kan worden gezegd dat het robuust, vertakt en omvangrijk is.
Kan u van dienst zijn: verplaatsingsreactieDe uiteinden van het isopentano -molecuul worden begrepen door CH -groepen3, die inefficiënt zijn als het gaat om het versterken van intermoleculaire interacties. Isopentano -moleculen zijn afhankelijk van de dispersieve krachten van Londen en hun massa om samenhangend te blijven en dus een vloeistof te definiëren in normale temperatuur- en drukomstandigheden.
De geometrie en de groepen zijn echter3 Ze zijn verantwoordelijk voor de isopentano -vloeistof die zeer vluchtig is en kookt bij een temperatuur van 28.2 ºC. Bijvoorbeeld de lineaire isomeer N-Pentano kookt rond 36 ° C, wat een weerspiegeling is van zijn beste intermoleculaire interacties.
Ondanks de duidelijke robuustheid is het isopentano -molecuul in staat om verschillende ruimteconfiguraties aan te nemen, een sleutelfactor bij het vaststellen van zijn glas bij een temperatuur van -160 ºC.
Eigenschappen
Fysiek uiterlijk
Vloeistof of kleurloos gas, met een waterige uitstraling, en dat geeft ook een geur af die vergelijkbaar is met die van benzine. Het is een zeer vluchtige stof.
Smeltpunt
De isopentano kristalliseert een temperatuurinterval tussen -161 en -159 ºC.
Kookpunt
De isopentano kookt tussen 27 met een temperatuurinterval.8 en 28.2 ºC. Daarom wordt het nauwelijks blootgesteld buiten uw container zal beginnen te koken en grote hoeveelheden stoom los te maken.
Dampdruk
76.9 kPa bij 20 ºC (ongeveer 0.76 ATM)
Dikte
0.6201 g/ml bij 20 ºC. Isopentano -dampen zijn 2.48 dichter dan lucht.
Oplosbaarheid
De isopentano voor een apolaire stof, is onoplosbaar en niet -menigbaar met water en sommige alcoholen. Het is oplosbaar en mengbaar in paraffine oplosmiddelen, ethers, koolstoftetrachloride, en ook in aromatische vloeistoffen zoals tolueen.
Kan u van dienst zijn: Quaternaire verbindingen: kenmerken, training, voorbeeldenBrekingsindex
1.354
Oppervlaktespanning
15 dyn/cm bij 20 ºC
Smurrie
0.214 CP bij 20 ºC
Flitspunt
-51 ºC. Deze temperatuur maakt de isopentano.
Zelf -richtingtemperatuur
420 ºC
Toepassingen
 Affectiecrèmes bevatten kleine isopentano -hoeveelheden die als drijfgas fungeren en de producttextuur geven. Bron: Pixabay.
Affectiecrèmes bevatten kleine isopentano -hoeveelheden die als drijfgas fungeren en de producttextuur geven. Bron: Pixabay. De isopentano is een organisch oplosmiddel dat dient als een manier van reactie voor bepaalde organische synthese, en vertegenwoordigt ook de grondstof voor de productie van andere verbindingen.
Het wordt toegevoegd aan benzine om zijn octaan te vergroten, en aan verschillende cosmetische producten om zijn textuur te verbeteren, zoals scheercrèmes, verdampt eenmaal snel en laat een borrelende massa achter.
Evenzo wordt polystyreen bevochtigd in isopentano, zodat het plastic bij het verdampen wordt uitgezet om een soort schuim te creëren, waarmee vaten, modellen, platen, bakken, enz.
Aan de andere kant wordt de isopentano gebruikt in cryogenie, samen met droog ijs en vloeibare stikstof, om biologische weefsels en monsters te bevriezen.
Het verkrijgen van
De isopentano kan worden verkregen uit de aardgasreservoirs, hoewel slechts 1% van zijn inhoud.
Een andere route, het meest gebruikt op industrieel niveau, is gebaseerd op N-Destillaat pentane van olieverfoleringsprocessen. Dan hij N-Pentano ondergaat een speciale reactie genaamd isomerisatie.
Het doel van de isomerisatie van N-Pentano moet zijn meest vertakte isomeren verkrijgen. Dus onder de producten hebben we niet alleen de isopentano, maar ook de neopentano. Deze reactie is mogelijk door zeer specifieke metaalkatalysatoren te gebruiken, welke regelen welke temperatuur en welke drukken vereist zijn.
Het kan u van dienst zijn: eigenschappen van covalente verbindingen (met voorbeelden)Risico's
De isopentano wordt beschouwd als een niet -toxische stof. Dit is deels te wijten aan de lage reactiviteit, omdat de C-C- of C-H-banden niet eenvoudig te breken zijn, zodat ze zich niet als zodanig interfereren in een metabolisch proces. In feite is een persoon in staat om grote hoeveelheden van zijn dampen in te ademen voordat hij verstikt, zonder blijkbaar te lijden aan onderpandschade.
Zijn inname veroorzaakt misselijkheid en braken, en zijn huidcontact eindigt. Aan de andere kant hebben medische studies niet in staat geweest om te specificeren of de isopentano een kankerverwekkende stof is. Het wordt echter beschouwd als een gevaarlijke verontreinigende stof voor mariene ecosystemen en hun fauna.
Het grootste gevaar rond isopentano is niet zozeer zijn reactiviteit, maar zijn ontvlambaarheid: het brandt met de zuurstof van de lucht. En omdat de vloeistof ervan zeer vluchtig is, zal de minste ontsnapping veel van zijn dampen losmaken naar de omgeving, die de minste nabijheid van een vlam of een andere warmtebron zal ontsteken.
Dat is de reden waarom producten die isopentano bevatten, moeten worden opgeslagen in veilige en frisse omgevingen.
Referenties
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e Editie.)). Wiley Plus.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Morrison en Boyd. (1987). Organische chemie. (Vijfde editie). Addison-Wesley IberoAmericana.
- Wikipedia. (2020). Isopentaan. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2020). Isopentaan. PubChem -database. CID = 6556. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Elsevier B.V. (2020). Isopentaan. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- Jennifer B. Galvin & Fred Marashi. (2010). 2-methylbutaan (isopentaan). Journal of Toxicology and Environmental Health, onderdeel van de huidige kwesties. Volume 58, 1999 -Issue 1-2. doen.org/10.1080/009841099157403
- « Safonifeerbare lipidenkenmerken, structuur, functies, voorbeelden
- Professionele ethiekkenmerken, belang, code, voorbeelden »

