Immunofluorescentie foundation, protocol en toepassingen
- 706
- 134
- Pete Heaney V
De immunofluorescentie Het is een krachtige immunomarcy -techniek die covalent antilichamen gebruikt voor fluorescerende moleculen om specifieke doelen te identificeren in celmonsters die zijn gefixeerd op een vaste ondersteuning.
Deze techniek Microscopische observatie met immuunspecificiteit, waardoor de waarneming van levende of dode cellen die kleine hoeveelheden antigenen kunnen hebben, mogelijk is. Het wordt veel gebruikt, zowel op het gebied van onderzoek als in de klinische diagnose van verschillende pathologieën.
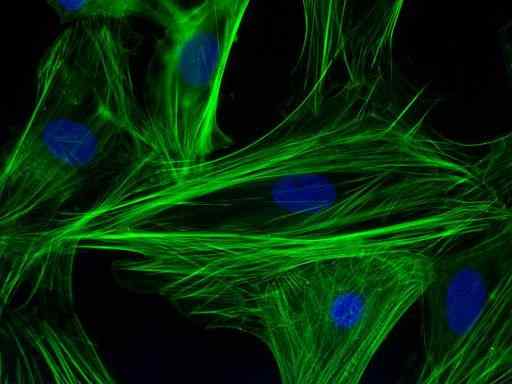
 Immunomariness van actinefilamenten in cardiomyocytencellen (Bron: PS1415 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Immunomariness van actinefilamenten in cardiomyocytencellen (Bron: PS1415 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) Deze voornamelijk kwalitatieve techniek (met enkele kwantitatieve varianten) moet specifiek doen met de visualisatie van een monster door het product van een fluorofoor, een fluorescerend molecuul dat aan een antilichaam is bevestigd en dat kan zichzelf op een bepaalde golflengte opwinden.
In de celcontext is het zeer nuttig om de aanwezigheid/afwezigheid en subcellulaire locatie van eiwitten te bestuderen. De techniek werd gebruikt in het begin van het klinische veld voor de diagnose van virussen zoals influenza en vervolgens voor vele andere infectieziekten.
Het is een techniek van grote gevoeligheid, en met het juiste microscopieteam kan het een zeer goede resolutie hebben. Het vereist, voor zijn observatie, het gebruik van confocale of epifluorescentiemicroscopen.
Ondanks dat u erg populair bent, kunt u echter enkele belangrijke problemen opleveren met betrekking tot het verkrijgen van niet -specifieke fluorescentie die een bepaalde "ruis" op de achtergrond genereert, wat vaak de juiste lezing van de resultaten beperkt.
[TOC]
Basis
Immunofluorescentie is gebaseerd op de exploitatie van het biologische fenomeen van de interactiereactie tussen een antilichaam en een antigeen. Het moet specifiek doen met de visualisatie of detectie van deze reactie wanneer opwindende fluorescerende moleculen op een specifieke golflengte.
Een antilichaam is een immunoglobuline -eiwit dat wordt uitgescheiden uit actieve B -cellen en wordt specifiek gegenereerd tegen een antigeen, dat kan worden verbonden met grote affiniteit en specificiteit. Immunofluorescentie maakt gebruik van IgG -immunoglobulines, die oplosbaar worden bevonden in bloedserum.
De antilichamen zijn moleculen tot 950 kDa samengesteld uit twee kort peptide (licht) en twee lengtes in de vorm van "y" (zwaar). Zowel lichte als zware ketens zijn verdeeld in twee domeinen: een variabele, in staat om het antigeen te herkennen, en een andere constante of bewaarde, kenmerkend voor elke soort.
Antigenen worden functioneel gedefinieerd als moleculen die kunnen worden herkend door een antilichaam en zijn meestal eiwitten. Wanneer een dier wordt blootgesteld aan een antigeen, worden immuunsysteem lymfocyten geactiveerd, waardoor specifieke antilichamen tegen worden geproduceerd en als een verdedigingssysteem functioneren.
Een antigeen, zoals een eiwit, kan bijvoorbeeld meer dan één epitoop of plaats van herkenning hebben voor een antilichaam, zodat het serum van het dier dat wordt blootgesteld aan een antigeen polyklonale antilichamen tegen verschillende gebieden van hetzelfde eiwit kan hebben.
Het kan je van dienst zijn: epidermis van de uiImmunofluorescentie benadrukt dus het vermogen van een dier om polyklonale antilichamen te produceren tegen een specifiek antigeen om het te zuiveren en het later te gebruiken voor de detectie van hetzelfde antigeen in andere contexten.
Among the most used fluorescent dyes or molecules for some immunofluorescence techniques are fluorescein isootiocyanate (FITC), tetramethylrodamine-5 and 6 (tritc) isochianate, many cyanines such as Cy2, Cy3, Cy5 and Cy7 and dyes called Alexa Fluor® , like the Alexa Fluor®448.
Protocol
Het immunofluorescentieprotocol varieert echter afhankelijk van vele factoren, en in het algemeen omvat een lineaire reeks stappen die bestaan uit:
- Bereiding van vellen en cellen
- Monsterfixatie
- Permeabilisatie
- Het blokkeren
- Immunotief of immunomarcaje
- Montage en observatie
-Voorbereiding
Van de monsters
De voorbereiding van de monsters hangt af van hun aard en het soort ervaring dat moet worden uitgevoerd. Vervolgens zal het eenvoudigste geval worden verklaard, wat het gebruik van gesuspendeerde cellen impliceert.
Suspensiecellen, dat wil zeggen in een vloeibare kweekmedium, moeten eerst hieruit worden gescheiden door centrifugeren en moeten vervolgens worden gewassen met een bufferoplossing of “buffer" Isosmotic, dat zijn integriteit behoudt.
Normaal gesproken wordt een fosfaat-salinebuffer gebruikt, bekend als PBS, waarin de cellen resuspend zijn.
Van de lakens
De vellen die worden gebruikt voor microscopische observatie, waarbij de cellen worden ingesteld voor de overeenkomstige stroomafwaartse behandelingen, moeten ook zorgvuldig worden voorbereid.
Deze worden bedekt of "gesensibiliseerd" met een polysine -oplossing, een synthetisch polymeer dat zal dienen als "moleculaire lijm" tussen cellen en vaste ondersteuning, dankzij de elektrostatische interactie tussen de positieve ladingen van hun aminogroepen en de negatieve ladingen van eiwitten die dekken die dekken cellen.
Monsterfixatie
Dit proces bestaat uit het immobiliseren van de eiwitten die zich in het cellulaire interieur bevinden om hun ruimtelijke locatie intact te houden. De gebruikte moleculen moeten in staat zijn om alle soorten celmembranen te kruisen en frames te vormen met covalente eiwitten.
De formaldehyde en paraformaldehyde, glutaaraldehyde en zelfs methanol worden veel gebruikt, waarmee celmonsters gedurende een bepaalde tijd worden geïncubeerd en deze vervolgens wassen met een isosmotische bufferoplossing.
Na de fixatie van de cellen blijft het zich aansluiten bij de eerder gesensibiliseerde vellen met polysine.
Permeabilisatie
Afhankelijk van het type test dat wordt uitgevoerd, is het nodig om de te bestuderen cellen te permeabiliseren of niet. Als wat wordt gezocht, is om de locatie, aanwezigheid of afwezigheid van een bepaald eiwit op het celoppervlak te weten, zal permeabilisatie niet nodig zijn.
Kan u van dienst zijn: fosfatidylinositol: structuur, training, functiesAan de andere kant, als u de locatie van een eiwit in het cellulaire interieur wilt weten, is permeabilisatie onmisbaar en zal bestaan uit het incuberen van monsters met Triton X-100, een wasmiddel dat in staat is celmembranen te persen.
Het blokkeren
Een fundamentele stap in alle immunologische technieken is blokkeren. In dit stadium van de procedure bestaat de blokkade uit het bedekken van, in de gesensibiliseerde vellen, alle locaties met polyesinemoleculen waaraan cellen niet werden gehecht. Dat wil zeggen, het voorkomt elke niet -specifieke unie.
Normaal gesproken worden voor het blokkeren van oplossingen met albumine van Whey Bovine (BSA) gebruikt in PBS -buffer en de beste resultaten worden verkregen, hoe langer het de incubatietijd is met deze oplossing. Na elke stap, inclusief de blokkade, is het noodzakelijk om de resterende oplossing te verwijderen door te wassen.
Immunotief of immunomarcaje
De immunomariness of immunomariness -procedure hangt voornamelijk af of het een directe of indirecte immunofluorescentie is (zie later).
Als het een primaire of directe immunofluorescentie is, worden de monsters geïncubeerd met de gewenste antilichamen, die moeten worden gekoppeld aan fluorescerende kleurstoffen. De incubatieprocedure bestaat uit het maken van een verdunning van het antilichaam in een oplossing die BSA ook zal bevatten, maar in een lagere verhouding.
Wanneer de zaak die van een secundaire of indirecte immunofluorescentie is, moeten twee opeenvolgende incubaties worden gemaakt. Eerst met de gewenste antilichamen en vervolgens met de antilichamen die de constante gebieden van primaire immunoglobulines kunnen detecteren. Het zijn deze secundaire antilichamen die covalent zijn voor fluoroforen.
De techniek is zeer veelzijdig, waardoor gelijktijdige tekens van meer dan één antigeen per monster kunnen, zolang ze primaire antilichamen hebben gekoppeld aan verschillende fluoroforen, in het geval van directe immunofluorescentie.
Voor gelijktijdige tekens bij indirecte immunofluorescentie is het noodzakelijk.
Net als de blokkade geeft incubatie met antilichamen betere resultaten hoe groter de tijd hiervan. Na elke stap is het noodzakelijk om de overtollige antilichamen te wassen die zich niet aan de monsters hebben aangesloten en in de secundaire immunofluorescentie is het nodig om te blokkeren voordat het secundaire antilichaam wordt toegevoegd.
Bepaalde technieken gebruiken andere kleurstoffen die niets te maken hebben met immunomariness, zoals nucleaire DNA -kleuring met DAPI -fluorofoor.
Montage en observatie
Tijdens de uiteindelijke incubatietijd met fluoroforen is het noodzakelijk dat de monsters in het donker blijven. Voor microscoopobservatie is het gebruikelijk.
Jongens
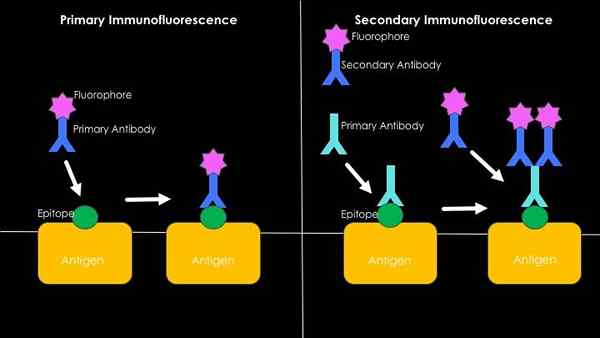 Grafische samenvatting van directe en indirecte immunofluorescentie (Bron: Westhayl618 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Grafische samenvatting van directe en indirecte immunofluorescentie (Bron: Westhayl618 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) Directe of primaire immunofluorescentie
Het heeft te maken met de detectie van antigenen door het gebruik van fluorescerende antilichamen. Het belangrijkste voordeel van het gebruik van deze techniek is de snelheid, maar veel gevallen van niet -specifieke unie kunnen in het proces plaatsvinden, met name bij het bestuderen van menselijke sera, omdat ze rijk zijn aan zeer heterogene antilichamen.
Kan u van dienst zijn: de 5 takken van de belangrijkste biotechnologieIndirecte of secundaire immunofluorescentie
Het is ook bekend als de "sandwich" -techniek en dit impliceert de ontwikkeling van de techniek in twee stappen. De eerste heeft te maken met het gebruik van een niet -fluorescerend antilichaam en zijn unie tegen het antigeen van belangstelling.
Tegen het constante gebied van dit eerste antilichaam (dat nu zal dienen als een antigeen) wordt een tweede antilichaam dat kan herkennen, dat wordt gebruikt, dat wordt geassocieerd met een fluorescerende molecuul.
Het uiterlijk van een fluorescerend signaal zal het resultaat zijn van de specifieke herkenning tussen het eerste niet -fluorescerende antilichaam en het interessante antigeen; De aanwezigheid van die eerste antilichaam omstandigheden die van de tweede, die wordt gelabeld en dankzij welke aanwezigheid of afwezigheid van het antigeen kan worden bepaald.
Ondanks dat het een techniek is die veel langer verbruikt dan directe immunofluorescentie (omdat het een meer incubatiestap omvat), impliceert deze techniek niet het ontwerp van een fluorescerend antilichaam voor elk bestudeerd antigeen, wat in economische termen resulteert, in economische termen, meer levensvatbaar.
Bovendien is het een meer gevoelige techniek in termen van signaalamplificatie, omdat meer dan één secundair antilichaam het constante gebied van het primaire antilichaam kan verbinden, waardoor de intensiteit van het fluorescerende signaal wordt versterkt.
Toepassingen
Zoals eerder opgemerkt, is immunofluorescentie een extreem veelzijdige techniek, waaraan veelvoud van gebruik in de wetenschappelijke en klinische gebieden is gegeven. Het kan worden gebruikt om ecologische, genetische en fysiologische vragen over veel organismen te beantwoorden.
Onder klinische toepassingen wordt het gebruikt voor de directe diagnose van sommige dermatologische aandoeningen, of het nu gaat om directe of indirecte immunofluorescentie op epitheelweefsel van de onderzochte patiënten.
Immunofluorescentietechnieken zijn gerangschikt in eencellige organismen zoals gisten om intranucleaire en cytoplasmatische microtubuli, actine en bijbehorende eiwitten, 10 nm filamenten en andere bestanddelen van het cytoplasma, membraan en celwanden te visualiseren, membraan en celwanden visualiseren.
Referenties
- Abcam, immunocytochemie en immunofluorescentieprotocol. Opgehaald uit Abcam.com
- Grafiek, c. (2012). Fluorescerende kleurstoffen. Opgehaald uit Leica-Microsystems.com
- Miller, D. M., & Shakest, D. C. (negentienvijfennegentig). Immunofluorescentiemicroscopie. In Methoden in celbiologie (Vol. 48, pp. 365-394). Academic Press, Inc.
- Odell, ik. D., & Cook, D. (2013). Immunofluorescentietechnieken. Journal of Investigative Dermatology, 133, 1-4.
- Prince, B. J. R., Adams, een. EN. M., Druain, D. G., & Brian, K. (1991). Immunofluorescentiemethoden voor YEAS. In Methoden van enzymologie (Vol. 194, pp. 565-602). Academic Press, Inc.
- Schaeffer, m., Orsi, e. V, & Widelock, D. (1964). Toepassingen van immunoflorentie in de virologie van de volksgezondheid. Bacteriologische beoordelingen, 28(4), 402-408.
- Vrieling, e. G., & Anderson, D. M. (1996). Immunofluorescentie in phytoplanktononderzoek: toepassingen en potentieel. J: Phycol., 32, 1-16.
- « Areolaire snelheid hoe het wordt berekend en opgelost oefeningen
- Alberto Fujimori regering eerste en tweede regering »

