Holmio

- 1426
- 423
- Pete Heaney V
 Metallic Holm Ultrapure monster. Bron: Hi-Res Images ofChemical Elements [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)]
Metallic Holm Ultrapure monster. Bron: Hi-Res Images ofChemical Elements [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)] Wat is de Holmio?
Hij Holmio Het is een metaalelement element dat bij het blok hoort F van het periodiek systeem, met name tot de periode van de lantaniden. Het is daarom een lid van de zeldzame aardes, naast de Erbio, Itrio, Disposio en Iterbio. Al deze vormen een reeks mineralen (Xenotima of Gadolinita) die moeilijk te scheiden zijn via conventionele chemische methoden.
Het chemische symbool is de HO, met een atoomnummer van 67, en minder overvloedig zijn dan de buren Disposio (66DY) en Erbio (68Eh). Er wordt dan gezegd dat Oddo-Harkins-regel gehoorzaamt. Holmius is een van die zeldzame metalen die bijna niemand het bestaan kent of vermoedt; Zelfs onder chemicaliën wordt het meestal niet heel vaak genoemd.
Op het gebied van geneeskunde staat Holmio bekend om het gebruik van zijn laser in operaties om prostaatpathologieën te bestrijden. Het vertegenwoordigt ook het veelbelovende materiaal voor de productie van elektromagneten en kwantumcomputers, vanwege zijn ongewone magnetische eigenschappen.
Holmium -verbindingen, drievoudige, ho3+, Ze presenteren de eigenaardigheid van het vertonen van een kleur die afhankelijk is van het licht waarmee ze bestralen zijn. Als dit fluorescerend is, verandert de kleur van deze verbindingen van geel naar roze. Evenzo gebeurt het met zijn oplossingen.
Geschiedenis
De ontdekking van de Holmio wordt toegeschreven aan twee Zwitserse chemicaliën, Marc Defontaine en Jacques-Louis Soret, die in 1878 spectroscopisch werd gedetecteerd tijdens het analyseren van Minerals van Rare Earths. Ze noemden hem element x.
Slechts een jaar later, in 1879, beheerde de Zweedse chemicus per Teodor Cleve2OF3)). Dit oxide, vervuild door andere onzuiverheden, vertoonde een bruine kleuring, die hij 'Holmia' noemde, wat een slag in het Latijn betekent.
Kan u van dienst zijn: exergonische reactie: kenmerken en voorbeeldenOok verkreeg Cleve nog een groen materiaal: 'Thulia', dat Tulio Oxide wordt. Het probleem van deze ontdekking is dat geen van de drie chemicaliën een voldoende monster pure van het Holm -oxide kon verkrijgen, omdat het werd besmet door Docch -atomen, een ander lanthanidetaal.
Het was niets anders dan in 1886 dat de Franse chemische stof, Paul Lecoq van Boisbaudran, het Holm -oxide isoleerde door gefractioneerde neerslag. Dit oxide onderging vervolgens chemische reacties om Holmio -zouten te produceren, die in 1911 werden verminderd door de Zweedse chemicus Otto Holmberg; En dus verschenen de eerste metalen Holm -monsters.
Momenteel echter, Holmio's ionen, Hol3+, Ze worden geëxtraheerd door ionenuitwisselingschromatografie, in plaats van toevlucht te nemen tot conventionele reacties.
Holm -eigenschappen
 Holmio -locatie in het periodieke tabel. Bron: Vectorisatie: Sushant Savla 05:51, 9 juni 2019 (UTC), CC BY-SA 4.0, via Wikimedia Commons
Holmio -locatie in het periodieke tabel. Bron: Vectorisatie: Sushant Savla 05:51, 9 juni 2019 (UTC), CC BY-SA 4.0, via Wikimedia Commons Fysiek uiterlijk
Zilver, zacht, ductiel en kneedbaar metaal.
Atoomnummer
67 (67Ho)
Molaire massa
164.93 g/mol
Smeltpunt
1461 ºC
Kookpunt
2600 ºC
Dikte
Bij kamertemperatuur: 8,79 g/cm3
Net wanneer smelt of smelt: 8,34 g/cm3
Fusiewarmte
17 kJ/mol
Verdampingswarmte
251 kJ/mol
Molaire warmtecapaciteit
27.15 J/(mol · k)
Elektronegativiteit
1.23 op de Pauling -schaal
Ionisatie -energieën
Eerst: 581,0 kJ/mol (ho+ gasvormig)
Tweede: 1140 kJ/mol (ho2+ gasvormig)
Derde: 2204 kJ/mol (ho3+ gasvormig)
Warmtegeleiding
16.2 w/(m · k)
Elektrische weerstand
814 nω · m
Oxidatienummers
De HOLM kan in zijn verbindingen worden gepresenteerd met de volgende getallen of oxidatietoestanden: 0, +1 (ho+), +2 (ho2+) en +3 (ho3+)). Van allemaal is +3 veruit de meest voorkomende en stabiele. Daarom is de HOLM een drievoudige metaal, dat verbindingen vormt (ionisch of gedeeltelijk ionisch) waar hij deelneemt als een ho ion3+.
Kan u van dienst zijn: ethylacetaatIn de volgende verbindingen wordt bijvoorbeeld de HOLM gevonden met +3 oxidatienummer: HO2OF3 (Ho23+OF32-), Ho (oh)3, HOI3 (Ho3+Je3-) en ho2(SW4))3.
De ho3+ En de elektronische overgangen zijn verantwoordelijk voor de verbindingen van deze metalen look bruin-geel. Wanneer ze echter uitstralen met fluorescerend licht, worden ze roze. Hetzelfde geldt voor hun oplossingen.
Isotopen
Holmio wordt in de natuur gepresenteerd als een enkele stabiele isotoop: 165HO (100% overvloed). Er zijn echter kunstmatige radio -isotopen met aanzienlijke halfwaardetijden. Tussen hen hebben we:
-163Ho (T1/2 = 4570 jaar)
-164Ho (T1/2 = 29 minuten)
-166Ho (T1/2 = 26.763 uur)
-167Ho (T1/2 = 3,1 uur)
Magnetische volgorde en moment
De Holm is een paramagnetisch metaal, maar het kan ferromagnetisch worden bij een temperatuur van 19 K, met zeer sterke magnetische eigenschappen. Het wordt gekenmerkt door het magnetische moment te hebben (10,6 μB) groter bij alle chemische elementen, evenals een ongebruikelijke magnetische permeabiliteit.
Reactiviteit
De Holm is een metaal dat in normale omstandigheden niet te snel oxy is, dus het duurt om zijn helderheid te verliezen. Wanneer hij echter met een lichter wordt verwarmd, wordt het geelachtig, product van de vorming van een oxidelaag:
4 ho + 3 o2 → 2 ho2OF3
Reageert met verdunde of geconcentreerde zuren om hun respectieve zouten te veroorzaken (nitraten, sulfaten, enz.)). En verrassend genoeg reageert het niet met fluorhorinezuur, omdat een HOF -laag3 beschermt het tegen zijn degradatie.
De Holmio reageert ook met alle halogenen om hun respectieve halogenuros te produceren (HOF3, Hocl3, Hobr3 en hoi3)).
Chemische structuur
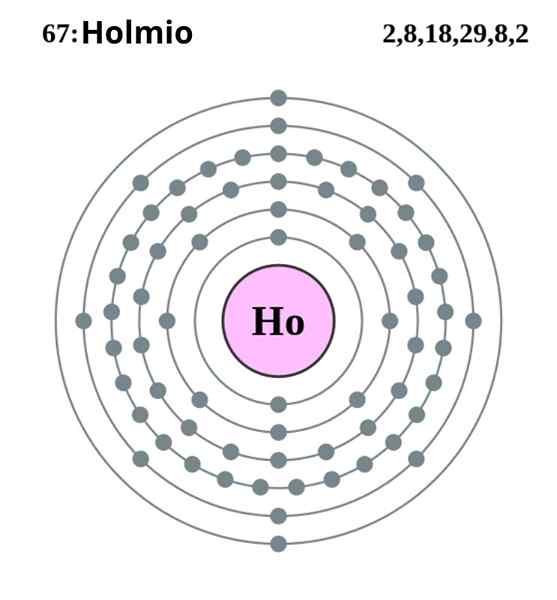 Holmio elektronische configuratie. Bron: Pumba (origineel werk van Greg Robson) Creative Commons Recognition-Share onder dezelfde licentie 2.0 Engeland en land van Wales
Holmio elektronische configuratie. Bron: Pumba (origineel werk van Greg Robson) Creative Commons Recognition-Share onder dezelfde licentie 2.0 Engeland en land van Wales De Holmio kristalliseert in een compacte hexagonale structuur, HCP (voor zijn acroniem in het Engels: hexagonal met dichtbij). In theorie blijven HO -atomen samenhangend dankzij de metaalbinding gevormd door de elektronen van hun 4F -orbitalen, volgens hun elektronische configuratie:
Kan u van dienst zijn: verdunning: concept, hoe het wordt gedaan, voorbeelden, oefeningen[XE] 4Felf 6s2
Dergelijke interacties, evenals het energiesysteem van zijn elektronen, definiëren de fysische eigenschappen van de Holmio. Dit metaal is geen andere alotrope of polymorfe bekend, zelfs niet onder hoge drukken.
Toepassingen
Nucleaire reacties
Het Holmio -atoom is een goede neutronenabsorberende, dus het helpt de ontwikkeling van nucleaire reacties te beheersen.
Spectroscopie
Holmio -oxide -oplossingen worden gebruikt om spectrofotometers te kalibreren, omdat hun absorptiespectrum bijna altijd blijft, ongeacht de onzuiverheden die het bevat. Het toont ook zeer karakteristieke acute banden geassocieerd met het Holmio -atoom, en niet aan de verbindingen.
Kleurstof
Holmio -atomen zijn in staat om roodachtige kleuringen te bieden aan glas en kunstmatige edelstenen van kubieke circumsite.
Magneten
Bij extreem lage temperaturen (30 K of minder) vertoont de Holmius interessante magnetische eigenschappen, die worden gebruikt om krachtige elektromen te produceren, waar het helpt om het resulterende magnetische veld te concentreren.
Dergelijke magnetische materialen zijn bestemd voor nucleaire magnetische resonantie; voor de ontwikkeling van harde schijven, met herinneringen die oscilleren in de volgorde van de petabytes of terabytes; en om kwantumcomputers mogelijk te produceren.
Holmio Laser
Een Ititrio-aluminium granaatkristal (YAG) kan doteren met Holmio-atomen om een straling uit te zenden waarvan de golflengte 2 urn is; Dat wil zeggen, we hebben een holm laser. Dankzij hem kan tumorweefsel precies worden gesneden zonder bloedingen te veroorzaken, omdat de energie de wonden onmiddellijk heeft geleverd.
Deze laser is herhaaldelijk gebruikt in prostaat- en tandheelkundige operaties, en om kankercellen en nierstenen te elimineren.

