Lithiumhydridestructuur, eigenschappen, het verkrijgen, gebruiken
- 5041
- 283
- Hugo Crooks
Hij Lithiumhydride Het is een kristallijne anorganische vaste stof waarvan de chemische formule lih is. Het is het meest lichte anorganische zout, het molecuulgewicht is slechts 8 g/mol. Het wordt gevormd door de vereniging van een lithium -ion li+ en een hydride h ion-. Beide zijn verenigd door een ionische obligatie.
Lih heeft een hoog smeltpunt. Het reageert gemakkelijk met water en in de reactie treedt waterstofgas voor. Het kan worden verkregen door reactie tussen gesmolten lithiummetaal en waterstofgas. Het wordt veel gebruikt in chemische reacties om andere hydroren te verkrijgen.
 Lithium Hydride, Lih. Geen machine-leesbare auteur verstrekt. Jtiago veronderstelde (op basis van copyrightclaims). [Publiek domein]. Bron: Wikimedia Commons.
Lithium Hydride, Lih. Geen machine-leesbare auteur verstrekt. Jtiago veronderstelde (op basis van copyrightclaims). [Publiek domein]. Bron: Wikimedia Commons. Lih is gebruikt voor bescherming tegen gevaarlijke straling, zoals die gevonden in kernreactoren, dit zijn alfa, bèta, gammastraling, protonen, x -reeks en neutronen.
Het is ook voorgesteld voor de bescherming van de materialen van de ruimteraketten verplaatst door nucleaire thermische voortstuwing. Studies worden zelfs gebruikt om te worden gebruikt als een bescherming van de mens tegen kosmische straling tijdens toekomstige reizen naar de planeet Mars.
[TOC]
Structuur
In lithiumhydride heeft waterstof een negatieve belasting h-, Welnu, een elektron is gestolen naar het metaal, dat in de vorm van Ion Li is+.
Elektronische kation -configuratie LI+ Het is: [hij] 1s2 dat is erg stabiel. En de elektronische structuur van hydride h- Het is: 1s2, die ook erg stabiel is.
Het kation en anion binden door elektrostatische krachten.
Het lithiumhydridekristal heeft dezelfde structuur als het natriumchloride, dat wil zeggen een kubieke kristallijne structuur.
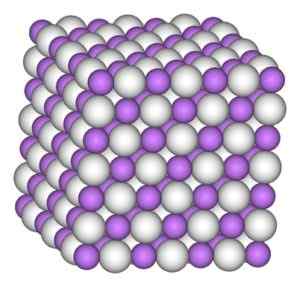 Kubieke kristallijne structuur van lithiumhydride. Auteur: Benjah-BMM27. Bron: Wikimedia Commons.
Kubieke kristallijne structuur van lithiumhydride. Auteur: Benjah-BMM27. Bron: Wikimedia Commons. Nomenclatuur
- Lithiumhydride
- Lih
Eigenschappen
Fysieke staat
Wit of kleurloze kristallijne vaste stof. Commercieel LIH kan grijsachtig blauw zijn vanwege de aanwezigheid van kleine hoeveelheden lithiummetaal.
Molecuulgewicht
8 g/mol
Smeltpunt
688 ºC
Kookpunt
Het ontleedt bij 850 ºC.
Zelf -richtingtemperatuur
200 ºC
Dikte
0,78 g/cm3
Oplosbaarheid
Reageren met water. Het is onoplosbaar in ethers en koolwaterstoffen.
Andere eigenschappen
Lithiumhydride is veel stabieler dan de hydros van de andere alkalische metalen en kan worden gesmolten zonder ontleding.
Kan u van dienst zijn: droge batterijHet wordt niet beïnvloed door zuurstof als het wordt verwarmd op temperaturen onder rood. Het wordt ook niet beïnvloed door chloor cl2 en HCl zoutzuur.
LIH -contact met warmte en vochtigheid veroorzaakt een exotherme reactie (genereert warmte) en waterstofevolutie H2 en lithiumhydroxide lioh.
Het kan een fijn stof vormen dat kan exploiteren in contact met vlammen, warmte- of oxiderende materialen. U mag geen contact opnemen met stikstofoxide of vloeibare zuurstof.
Het wordt donker door te worden blootgesteld aan licht.
Het verkrijgen van
Lithiumhydride is verkregen in het laboratorium door reactie tussen gesmolten lithiummetaal en waterstofgas bij een temperatuur van 973 K (700 ° C).
2 Li + H2 → 2 Lih
Goede resultaten worden verkregen wanneer het blootgestelde oppervlak van het gesmolten lithium wordt verhoogd en wanneer de LIH -sedimentatietijd wordt verkort. Het is een exotherme reactie.
Ik gebruik als een beschermend schild tegen gevaarlijke straling
Lih presenteert een reeks kenmerken die het aantrekkelijk maken om te worden gebruikt als bescherming voor de mens in kernreactoren en ruimtesystemen. Hier zijn enkele van deze kenmerken:
- Het heeft een hoog waterstofgehalte (12,68 % per gewicht van h) en een hoog aantal waterstofatomen per volume -eenheid (5,85 x 1022 H/cm atomen3)).
- Door het hoge smeltpunt kan het worden gebruikt in omgevingen op hoge temperatuur zonder te worden opgericht.
- Het heeft een lage dissociatiedruk (~ 20 torr op het smeltpunt) waardoor het materiaal kan worden gegoten en bevroren zonder af te breken onder lage waterstofdruk.
- Het heeft een lage dichtheid waardoor het aantrekkelijk is om te worden gebruikt in ruimtesystemen.
- Hun nadelen zijn echter hun lage thermische geleidbaarheid en slechte mechanische eigenschappen. Maar dit heeft zijn toepasbaarheid niet verminderd.
- Lih -stukken die als schilden dienen, worden vervaardigd door koude of hete drukken en door fusie en in schimmels gieten. Hoewel deze laatste vorm de voorkeur heeft.
- Bij kamertemperatuur worden de onderdelen beschermd tegen water- en waterdamp.
- In kernreactoren
In kernreactoren zijn er twee soorten straling:
Kan u van dienst zijn: zuren en basen in het dagelijks leven: reacties, gebruik, voorbeeldenDirecte ioniserende straling
Het zijn zeer energiedeeltjes die elektrische lading dragen, zoals alfa (α) en bèta (β) en protonendeeltjes. Deze soorten straling werken zeer sterk in wisselwerking met de materialen van de schilden, waardoor ionisatie wordt veroorzaakt bij interactie met de elektronen van de materialen van de materialen waardoor ze passeren.
Indirect ioniserende straling
Het zijn neutronen, gammastralen (γ) en x -stralen, die doordringen en massabescherming vereisen, omdat ze de emissie van geladen secundaire deeltjes inhouden, die ionisatie veroorzaken.
 Symbool om te waarschuwen voor gevaarlijke straling. IAEA & ISO [Public Domain]. Bron: Wikimedia Commons.
Symbool om te waarschuwen voor gevaarlijke straling. IAEA & ISO [Public Domain]. Bron: Wikimedia Commons. Volgens sommige bronnen is LIH effectief in het beschermen van materialen en mensen tegen dit soort straling.
- In nucleaire thermische voortstuwingsruimtesystemen
Lih is onlangs gekozen als een potentiële moderator en beschermend materiaal tegen nucleaire straling voor nucleaire thermische aandrijfsystemen van ruimtevaartuigen voor zeer lange reis.
 Artistieke weergave van ruimtevoertuig met nucleaire voortstuwing in de baan van Mars. NASA/SAIC/Pat Rawlings [Public Domain]. Bron: Wikimedia Commons.
Artistieke weergave van ruimtevoertuig met nucleaire voortstuwing in de baan van Mars. NASA/SAIC/Pat Rawlings [Public Domain]. Bron: Wikimedia Commons. De lage dichtheid en het hoge waterstofgehalte veroorzaakt de massa en het volume van de nucleaire voortstuwingsreactor om effectief te verminderen.
- In bescherming tegen kosmische straling
Blootstelling aan ruimtestraling is het belangrijkste risico op de gezondheid van de mens in toekomstige interplanetaire exploratiemissies.
In de diepe ruimte zullen astronauten worden blootgesteld aan het volledige spectrum van galactische kosmische stralen (hoge energie -ionen) en gebeurtenissen voor zonne -deeltjes (protonen).
Het gevaar van blootstelling aan straling wordt verergerd vanwege de duur van de missies. Bovendien moeten de bescherming van de plaatsen waar ook ontdekkingsreizigers worden overwogen.
 Toekomstige habitatsimulatie op planeet Mars. NASA [Public Domain]. Bron: Wikimedia Commons.
Toekomstige habitatsimulatie op planeet Mars. NASA [Public Domain]. Bron: Wikimedia Commons. In deze volgorde van ideeën gaf een onderzoek in 2018 aan dat LIH onder de bewezen materialen de hoogste stralingsreductie per gram per cm biedt2, Dus een van de beste kandidaten zijn die wordt gebruikt in bescherming tegen kosmische straling. Deze studies moeten echter worden verdiept.
Ik gebruik als opslagmiddel en veilig waterstoftransport
Energie verkrijgen van h2 Het is iets dat al tientallen jaren is bestudeerd en al een aanvraag heeft gevonden om fossiele brandstoffen in transportvoertuigen te vervangen.
Kan u van dienst zijn: chemisch evenwicht: uitleg, factoren, typen, voorbeeldenDe H2 Het kan worden gebruikt in brandstofcellen en bijdragen aan de vermindering van de co -productie2 en nietX, waardoor het broeikaseffect en de vervuiling worden vermeden. Een effectief systeem voor het opslaan en transport van H is echter nog niet gevonden2 Zeker, met lichtgewicht, compact of klein gewicht, dat het snel rijdt en de h vrijgeeft2 even snel.
Lih lithiumhydride is van alkalische hydroren die de hoogste opslagcapaciteit van h hebben2 (12,7 % per gewicht van h). Release h2 door hydrolyse volgens de volgende reactie:
Lih + H2O → liOH + H2
De LIH levert 0,254 kg waterstof voor elke kg lih. Bovendien heeft het een hoge opslagcapaciteit per volume -eenheid, wat betekent dat het licht is en een compact medium is voor H -opslag2.
 Motorfiets waarvan de brandstof waterstof is opgeslagen in de vorm van een metaalhydride zoals Lih. OF.S. Doe energie -efficiënte en hernieuwbare energie (VS) [Public Domain]. Bron: Wikimedia Commons.
Motorfiets waarvan de brandstof waterstof is opgeslagen in de vorm van een metaalhydride zoals Lih. OF.S. Doe energie -efficiënte en hernieuwbare energie (VS) [Public Domain]. Bron: Wikimedia Commons. Bovendien is LIH gemakkelijker gevormd dan andere alkalische metaalhydroren en is chemisch stabiel bij milieutemperaturen en drukken. Lih kan van de fabrikant of leverancier naar de gebruiker worden getransporteerd. Dan door hydrolyse van de lih wordt de H gegenereerd2 En dit wordt veilig gebruikt.
Lioh -gevormde lithiumhydroxide kan worden teruggestuurd naar de leverancier die lithium regenereert door elektrolyse, en vervolgens opnieuw geproduceerd Lih.
De Lih is ook met succes bestudeerd om samen met de Bold Hydraccin te worden gebruikt voor hetzelfde doel.
Gebruik in chemische reacties
Lih staat complexe hydrors synthese toe.
Het dient bijvoorbeeld om lithiumtriethylborohydride te bereiden, is een krachtige nucleofiel in organische haluros verplaatsingsreacties.
Referenties
- Sato, en. En Takeda, of. (2013). Waterstofopslag en transportsysteem door lithiumhydride met behulp van gesmolten zouttechnologie. In gesmolten zouten chemie. Hoofdstuk 22, pagina's 451-470. Hersteld van Scientedirect.com.
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Lithiumhydride. Hersteld van: pubchem.NCBI.NLM.NIH.Gov.
- Wang, L. et al. (2019). Onderzoek naar de impact van het effect van het themal-kernel van lichiumhydride op de reactief van nucleair. Annals of Nuclear Energy 128 (2019) 24-32. Hersteld van Scientedirect.com.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Giraudo, m. et al. (2018). Op versnellingsbak gebaseerde tests van afschermingseffectivess van verschillende materialen en multiyers met behulp van high-eergy lichte en zware ionen. Radiation Research 190; 526-537 (2018). NCBI hersteld.NLM.NIH.Gov.
- Welch, f.H. (1974). Lithium Hydride: een ruimtemateriaal voor het afscherming van ruimtetijdperk. Nuclear Engineering and Design 26, 3, februari 1974, pagina's 444-460. Hersteld van Scientedirect.com.
- Simnad, m.T.(2001). Nucleaire reactoren: afschermingsmaterialen. In Encyclopedia of Materials: Science and Technology (tweede editie). Pagina's 6377-6384. Hersteld van Scientedirect.com.
- Hügy, t. et al. (2009). Hydrazine Borane: een veelbelovend waterstofopslagmateriaal. J. BEN. Chem. SOC. 2009, 131, 7444-7446. Hersteld van pubs.ACS.borg.
- « Amenadiel Betekenis, aanwezigheid in de Bijbel en Lucifer
- Mayan Medicine History, God, planten, ziekten »

