Aromatische koolwaterstoffen eigenschappen, voorbeelden, toepassingen
- 3948
- 414
- Ernesto McKenzie
De aromatische of zandkoolwaterstoffen Ze zijn een reeks organische verbindingen die alleen uit koolstofatomen en hydrogenen zijn samengesteld, en die worden gekenmerkt door eenheden van benzeenringen in hun moleculaire structuren.
Sommigen, zoals zijn naam benadrukt, vuurt zoete en aangename geuren aan; reden waarom de eerste organische chemicaliën hen aromatisch noemden. Methaangas is bijvoorbeeld een toiletkoolwaterstof; Terwijl tolueen, vluchtige vloeistof, presenteert een redelijk eigenaardige en sterke geur.
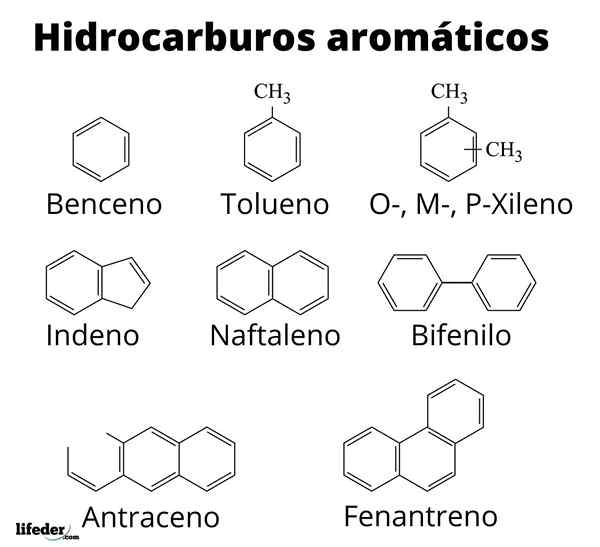
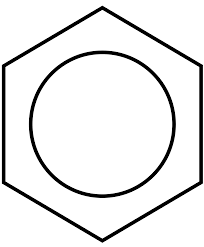
 Aromatische koolwaterstoffen worden herkend door Benncytenic Rings -eenheden
Aromatische koolwaterstoffen worden herkend door Benncytenic Rings -eenheden In de bovenste afbeelding hebben we een soort netwerk of gaas bestaande uit benzenische ringen. Let op je zeshoekige geometrieën en de cirkel binnenin. Deze cirkel vertegenwoordigt wat bekend staat als aromaticiteit, die een volledig chemische en niet -fysieke eigenschap is, onafhankelijk van de geuren van deze koolwaterstoffen.
Aromatische koolwaterstoffen behoren tot de belangrijkste, geëxtraheerde of geproduceerde, olie- en koolstofmineralen. Benzeen is de hoeksteen van deze koolwaterstoffen en hun toepassingen, omdat het daarvan symfines ontleent aan verbindingen die worden gebruikt als grondstof voor de productie van meststoffen, kunststoffen, lijmen, wasmiddelen, parfums, medicijnen, enz.
[TOC]
Hoe worden aromatische koolwaterstoffen genoemd?
Een enkele benzeenring
Voor aromatische koolwaterstoffen hebben we de eigenaardigheid die hun traditionele of gemeenschappelijke namen meestal overheersen boven degenen die worden geregeerd door de IUPAC -nomenclatuur.
Allen bevatten de benzeenring, of een ring die aan de aromaticiteitseigenschap voldoet. De eenvoudigste kunnen worden genoemd volgens Benzeen en de relatieve posities van hun substituenten.
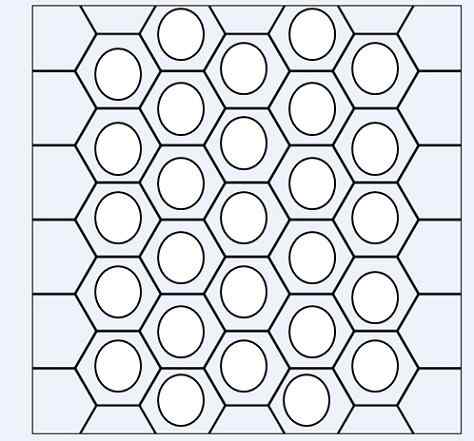
 Relatieve posities van de substituenten in een benzenische ring voor het dimethylbenzeenmolecuul. Bron: Gabriel Bolívar via Molview.
Relatieve posities van de substituenten in een benzenische ring voor het dimethylbenzeenmolecuul. Bron: Gabriel Bolívar via Molview. Overweeg bijvoorbeeld de bovenste afbeelding. In de drie structuren zien we de zeshoekige ring van de benzeen, die twee methylsubstituenten heeft, cho3. Aldus wordt deze verbinding dimethylbenzeen genoemd, omdat deze bestaat uit een benzeen met twee methylos.
Kan u dienen: kaliumsulfaat (k2SO4): structuur, eigenschappen, gebruik, syntheseVan links naar rechts zien we dat de scheiding tussen de twee3 Het wordt groter, wat niet alleen de fysische eigenschappen van het molecuul beïnvloedt, maar ook hun respectieve namen wijzigt. Om ze te onderscheiden, omdat ze allemaal dimethylbenzeen worden genoemd, ortho-voorvoegsels (O-), doel (m-) en voor (p-) worden gebruikt (p-).
Daarom, en nogmaals, van links naar rechts hebben we: ortho-dimethylbenzeen, meta-dimethylbenzeen en parameterBenzeen. De traditionele naam voor deze verbinding is echter het xyleen, dus namen worden: ortho-xyleen, meta-xyleen en para-xyleen.
Als er meer dan twee verschillende substituenten zijn, wordt het gebruikt om koolstoffen op te sommen volgens dezelfde nomenclatuurregels als voor alle koolwaterstoffen.
Meerdere ringen
Voor aromatische koolwaterstoffen met meer dan één benzenische ring worden traditionele namen nog belangrijker. Dit komt omdat de systematische namen die hun structuren beschrijven, omslachtig en moeilijk te onthouden zijn. Beschouw het voorbeeld van naftaleen:
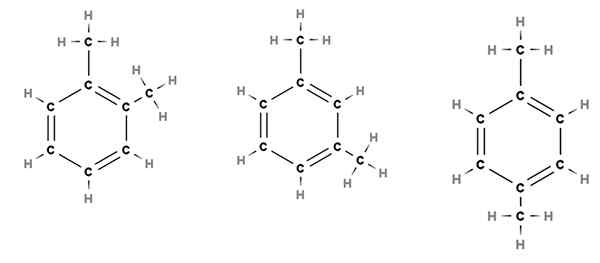
 Naftaleenstructuur
Naftaleenstructuur Naftaleen is ook commercieel bekend als naftaline of witte kamfer. De systematische naam is echter: Biciclo [4,4,0] dec-1,3,5,7,9 pentane. En dit alleen voor een compound met twee samengevoegde benzenische ringen; De nomenclatuur wordt veel ingewikkelder voor verbindingen met drie of meer ringen.
Eigenschappen van aromatische koolwaterstoffen
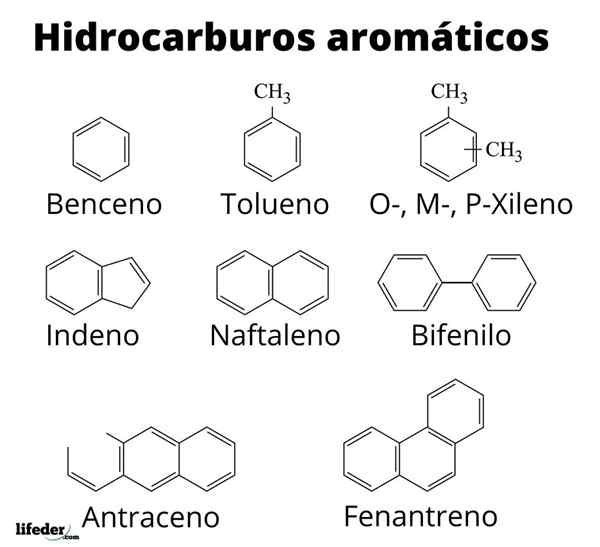 Structuur van sommige aromatische koolwaterstoffen
Structuur van sommige aromatische koolwaterstoffen Aromaticiteit
Aromatische koolwaterstoffen bevatten ringen die de regels van Hucdel gehoorzamen. Dat wil zeggen, hun ringen moeten atomen hebben met SP -hybridisaties2, Wees zo vlak mogelijk, en heb een aantal geëlocificeerde π -elektronen gelijk aan 4N + 2. Benzeen is bijvoorbeeld aromatisch omdat het 6 gedemoceerde elektronen heeft voor N= 1 (4 · 1 + 2 = 6).
Hoge C/H -relaties
C/H -relaties voor aromatische koolwaterstoffen zijn hoog of groter dan 1. Bijvoorbeeld voor benzeen, c6H6, Uw c/h is gelijk aan 6/6 of 1. Ondertussen, voor naftaleen, c10H8, Uw c/h is gelijk aan 10/8 of 1.25. Wat betekent dit? Dat deze koolwaterstoffen zeer "koolzuurhoudend" zijn in vergelijking met andere verbindingen.
Kan u dienen: Sulfonzuur: structuur, nomenclatuur, eigenschappen, gebruikGele vlammen
Precies vanwege hun hoge C/H -relaties, wanneer aromatische koolwaterstoffen worden verbrand Vuurgele vlammen, product van de gevormde kolendeeltjes (roet).
Vervangingsreacties
Aromatische koolwaterstoffen kunnen hun waterstofatomen vervangen door andere substituent. Dit wordt bereikt door twee soorten organische reacties: aromatische elektrofiele substitutie (Sear), of aromatische nucleofiele substitutie (SNAR).
Geuren
Aromatische koolwaterstoffen, zoals hun naam al doet vermoeden, worden gekenmerkt door zoete of sterke geuren. Met deze eigenschap konden ze ze in principe onderscheiden van gasvormige koolwaterstoffen en sommige keverparaffines.
Voorbeelden van aromatische koolwaterstoffen
Aromatische koolwaterstoffen, strikt genomen, betreffen alleen die welke zijn samengesteld uit koolstof en waterstof. Er mogen geen heteroátomos zijn (of P, N, S, enz.)). Daarom laten de volgende voorbeelden die worden vermeld over aan verbindingen zoals pyridine, furano of fenol.
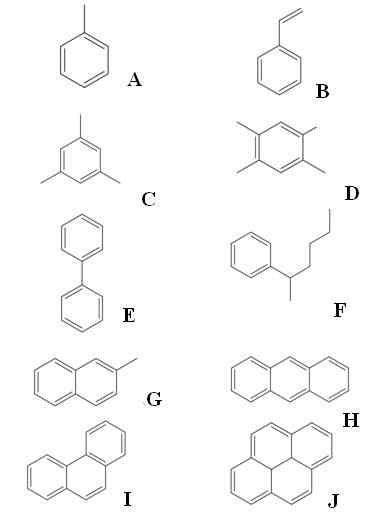 Voorbeelden van aromatische koolwaterstoffen. Bron: Gabriel Bolívar via Molview.
Voorbeelden van aromatische koolwaterstoffen. Bron: Gabriel Bolívar via Molview. We hebben tien voorbeelden van aromatische koolwaterstoffen. Merk op dat iedereen minstens één benzenische ring heeft. Hun namen zijn:
A: Toluene
B: stretch
C: Mesitileno
D: laat
E: Bifenyl
F: 2-Fenilhexan
G: 2-methylnasaleen
H: Anthracen
I: Fenantreno
J: Pireno
Van allemaal is Toluene degene met de grootste industriële waarde.
Toepassingen/gebruik
De meeste toepassingen van aromatische koolwaterstoffen bestaan uit het dienen als grondstof voor synthese of productie, producten met hoge commerciële waarde. Bijna allemaal beginnen ze bij benzeen, dat wordt onderworpen aan verschillende organische reacties om functionele derivaten te verkrijgen.
Vezels en kunststoffen
 Benzeen
Benzeen Uit benzeen is er cyclohexaan, dat vervolgens wordt omgezet in andere verbindingen om de nylon 6 of nylon 66 te synthetiseren. Aan de andere kant kan het stuk ook worden verkregen uit het benzeen, dat bestaat uit het polystyreenmonomeer. We hebben dus polymeren die nodig zijn voor de productie van vezels en kunststoffen.
Kan u van dienst zijn: activeringsenergieEpoxyharsen
Uit benzeen kan ook bisfenol A worden gesynthetiseerd, waarmee, volgens verschillende routes van synthese, epoxyharsen, lijm, lijmen en zelfs schilderijen optreden.
Wasmiddelen
Alkybentes met lange zijketens dienen voor de productie van wasmiddelen; Onder hen, alkybenzeosulfonaten.
TNT
Uit tolueen kunt u TNT produceren: trinitrotolueen, een van de bekendste explosieven.
Benzoëzuur
Uit tolueen wordt benzoëzuur verkregen als afgeleid, essentiële verbinding voor de formuleringen van veel parfums, medicijnen en voedsel.
Oplosmiddelen
Benzeen, tolueen en xileno (BTX) zijn de meest gebruikte organische oplosmiddelen in olieonderzoek.
Benzine
Aromatische koolwaterstoffen maken ook deel uit van de samenstelling van benzine, met de belangrijkste rol van het verhogen van de octaan- of octaanindex.
Referenties
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e Editie.)). Wiley Plus.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Morrison en Boyd. (1987). Organische chemie. (Vijfde editie). Addison-Wesley IberoAmericana.
- Wikipedia. (2020). Aromatische verbinding. Opgehaald uit: in.Wikipedia.borg
- Ed Vitz et al. (8 september 2020). Aromatische koolwaterstoffen. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Wyman Elizabeth. (2020). Aromatische koolwaterstoffen: definitie, voorbeeld en gebruik. Studie. Hersteld van: studie.com
- Boluda, c. J., Macías, m., & González Marrero, J. (2019). De chemische complexiteit van automotive benzine. Wetenschap, engineering en applicaties,2(2), 51-79. Doi: doi.org/10.22206/cyap.20199999999999999999999999999999999999999111 2019 2019 20199999 E moetene9999191999998311133113331322111152222222111231311111111111122111111111121111111111111111111111111111 -11111111111a's11111a's1a's1a's1a's1a's1a's D1a's Dam dat ’TO.V2I2.PP51-79
- « Behoud van het lineaire momentia -principe, voorbeelden, oefeningen.
- Gebeden met G -voorbeelden en gebruiksregels »

