Structuur van stikstofzuur (HNO2), eigenschappen, synthese

- 4568
- 1162
- Miss Herman Russel
Hij stikstofzuur Het is een zwak, anorganisch zuur, wiens chemische formule hno is2. Het is fundamenteel in waterige oplossing met een lichtblauwe kleuring. Het is erg onstabiel en het wordt snel verbroken in stikstofoxide, nee en in salpeterzuur, ino3.
Het is meestal in waterige oplossing in de vorm van nitrieten. Het komt natuurlijk ook uit de atmosfeer als gevolg van de reactie van stikstofoxide met water. Daar, met name in de troposfeer, komt stikstofzuur tussenbeide in de regulatie van de ozonconcentratie.
 Stikstofzuuroplossing in een beker. Bron: Geen machine-leesbare auteur verstrekt. De Mad Scientist ~ Commonswiki nam aan (op basis van auteursrechtclaims). [Publiek domein]
Stikstofzuuroplossing in een beker. Bron: Geen machine-leesbare auteur verstrekt. De Mad Scientist ~ Commonswiki nam aan (op basis van auteursrechtclaims). [Publiek domein] In het bovenste beeld wordt een HNO -oplossing getoond2 waar de karakteristieke lichtblauwe kleur van dit zuur te zien is. Het wordt gesynthetiseerd door het oplossen van stikstoftrioxide, n2OF3, In water. Evenzo is het het product van de verzuring van natriumnitrietoplossingen bij lage temperaturen.
De HNO2 Het heeft weinig commercieel gebruik, gebruikt in de vorm van nitriet in het behoud van vlees. Aan de andere kant wordt het gebruikt bij de uitwerking van azoïsche kleurstoffen.
Het wordt gebruikt, samen met natriumthiosulfaat, bij de behandeling van patiënten met natriumcyanidevergiftiging. Maar het is een mutagene middel en er wordt gedacht dat het substituties kan veroorzaken in de basen van de DNA -ketens, door een oxidatieve deaminatie van de cytosine en adenine.
Stikstofzuur heeft een dubbel gedrag, omdat het zich kan gedragen als een oxidatief middel of als een reductiemiddel; dat wil zeggen, het kan worden gereduceerd tot NO of N2, oxideren3.
[TOC]
Stikstofzuurstructuur
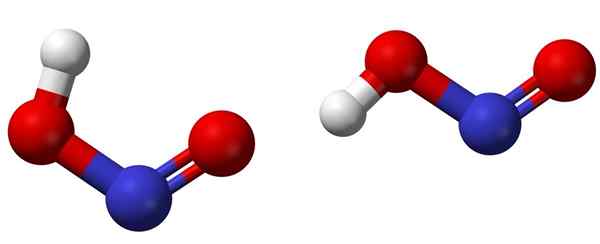 Cis (links) en trans (rechts) isomeren met de respectieve moleculaire structuren van HNO2. Bron: Ben Mills [Public Domain].
Cis (links) en trans (rechts) isomeren met de respectieve moleculaire structuren van HNO2. Bron: Ben Mills [Public Domain]. Het bovenste beeld toont de moleculaire structuur van stikstofzuur door middel van een bollen en stavenmodel. Het stikstofatoom (blauwe bol) bevindt zich in het midden van de structuur en vormt een dubbele binding (n = O) en een eenvoudige (N-O) met zuurstofatomen (rode bollen).
Merk op dat het waterstofatoom (witte bol) is gekoppeld aan een van de zuurstof en niet direct aan stikstof. Dus, wetende dit, de structurele formule van de HNO2 Het is [ho-n = o] of [nee (oh)], en er is geen dergelijke H-n-link (zoals de chemische formule kan denken).
De beeldmoleculen komen overeen met die van een gasfase; In het water worden ze omgeven door watermoleculen, die het waterstofion (zwak) kunnen accepteren om de ionen niet te vormen2- en h3OF+.
Kan u van dienst zijn: bekerDe structuren kunnen twee vormen aannemen: cis of trans, geometrische isomeren genoemd. In het CIS -isomeer wordt het H -atoom overschaduwd met het naburige zuurstofatoom; Terwijl in het trans -isomeer, beide worden gevonden in anti -opposietposities.
In het CIS-isomeer is de vorming van een intramoleculaire waterstof (OH-NO) waarschijnlijk, die intermoleculair kan importeren (Onoh-onoH).
Eigenschappen
Chemische namen
-Stikstofzuur
-Dioxonitric Acid (III)
-Nitrosielhydroxide
-Hydroxideoxidonitrogen (IUPAC Systematische naam)
Fysieke beschrijving
Lichtblauwe vloeistof, overeenkomend met de nitrietoplossing.
Molecuulgewicht
47,013 g/mol.
Dissociatie constant
Het is een zwak zuur. De PKA is 3,35 tot 25 ºC.
Smeltpunt
Is alleen bekend in oplossing. Daarom kan uw smeltpunt niet worden berekend, noch kunnen uw kristallen worden geïsoleerd.
Kookpunt
Door niet puur maar in water te bestaan, zijn de metingen van deze eigenschap niet precies. Enerzijds hangt het af van de concentratie van de HNO2, En aan de andere kant produceert de opwarming zijn ontleding. Daarom wordt een exact kookpunt niet gemeld.
Verkoopvorming
Oplosbaar water -oplosbare nitrieten met LI+, NA+, K+, AC2+, Dhr2+, Ba2+. Maar vorm geen zouten met veelzijdige kationen, zoals: aan de3+ en/of zijn2+ (vanwege de hoge belastingdichtheid). Het is in staat om stabiele esters te vormen met alcoholen.
Brandpotentieel
Het is ontvlambaar voor chemische reacties. Kan exploderen door contact met fosfor -trichloride.
Ontleding
Het is een zeer onstabiele verbinding, en in waterige oplossing ontleedt het in stikstofoxide en salpeterzuur:
2 hno2 => Nee2 + NO +H2OF
4 HNO2 => 2 hno3 + N2Of +h2OF
Reduceren
Stikstofzuur in waterige oplossing wordt gepresenteerd in de vorm van nitrietionen, nee2-, die verschillende reductiereacties ervaren.
Reageert met ionen i- en geloof2+, In de vorm van kaliumnitriet, om stikstofoxide te vormen:
2 Kno2 + Ki +h2SW4 => I2 + 2 Nee +2 H2Of +K2SW2
Kaliumnitriet in aanwezigheid van tinionen wordt gereduceerd om stikstofoxide te vormen:
Kno2 + 6 HCl +2 SNCL2 => 2 sncl4 + N2O +3 H2O +2 KCL
Kan u van dienst zijn: berylhydroxide (be (oh) 2)Kaliumnitriet wordt verminderd door Zn in een alkalische omgeving, waardoor ammoniak wordt gevormd:
5 H2O +kno2 + 3 Zn => NH3 + KOH +3 Zn (OH)2
Oxidatiemiddel
Naast een reductiemiddel kan stikstofzuur ingrijpen in oxidatieprocessen. Bijvoorbeeld: oxideren tot waterstofsulfide, salpeter- of ammoniakoxide worden, afhankelijk van de zuurgraad van het medium waarin de reactie optreedt.
2 hno2 + H2S => S +2 NO +2 H2OF
Hno2 + 3 H2S => S +NH3 + 2 H2OF
Stikstofzuur kan in een zure pH -medium jodide -ion oxideren tot jodium.
Hno2 + Je- + 6 H+ => 3 i2 + NH3 + 2 H2OF
U kunt ook fungeren als een reductiemiddel dat op Cu werkt2+, salpeterzuur veroorzaken.
Nomenclatuur
Aan de hno2 U kunt andere namen geven, die afhankelijk zijn van het type nomenclatuur. Stikstofzuur komt overeen met de traditionele nomenclatuur; dioxonitriczuur (III), naar de voorraadnomenclatuur; en dioxonitraat (III) van waterstof, tot systematische.
Synthese
Stikstofzuur kan worden gesynthetiseerd door stikstoftrioxide in water op te lossen:
N2OF3 + H2O => 2 hno2
Een andere bereidingsmethode is de reactie van het natriumnitriet, nano3, met minerale zuren; zoals zoutzuur en bromhyterinezuur. De reactie wordt gemaakt bij lage temperatuur en het stikstofzuur wordt in situ geconsumeerd.
Oudere broer3 + H+ => Hno2 + NA+
De H+ Het komt van HCL of HBR.
Risico's
Gezien de chemische eigenschappen en kenmerken is er weinig informatie over de directe toxische effecten van de HNO2. Misschien worden enkele schadelijke effecten waarvan wordt aangenomen dat ze door deze verbinding worden geproduceerd, daadwerkelijk veroorzaakt door salpeterzuur, dat kan optreden door het ontbinden van stikstofzuur.
Er wordt op gewezen dat de HNO2 Het kan schadelijke effecten hebben op de luchtwegen en in staat zijn om symptomen van irritatie te produceren bij astmapatiënten.
In de vorm van natriumnitriet wordt het verminderd door deoxyhemoglobine, waardoor stikstofoxide wordt geproduceerd. Dit is een krachtige vaatverwijder die ontspanning van de vasculaire gladde spieren produceert, waarbij bij mensen een LD50 -dosis van 35 mg/kg schatten voor mondelinge consumptie.
Natriumnitriettoxiciteit wordt gemanifesteerd met een cardiovasculaire ineenstorting, gevolgd door ernstige hypotensie, vanwege vaatverwijdende werking van stikstofoxide, geproduceerd uit nitriet.
Stikstofdioxide, nee2, Aanwezig in vervuilde lucht (smog), onder bepaalde omstandigheden kan het stikstofzuur veroorzaken; die op zijn beurt kunnen reageren met amines om nitrosamine te vormen, een gamma van carcinogene verbindingen.
Het kan u van dienst zijn: zilveroxide (Ag2o)Een vergelijkbare reactie treedt op met de rook van sigaretten. Nitrosamineresten die zich aan de binnenvoering van rokende voertuigen hebben vastgelegd, zijn gevonden.
Toepassingen
Diazonium verkoopproductie
Stikstofzuur wordt in de industrie gebruikt bij de productie van diazoniumzouten, door zijn reactie met aromatische amines en fenolen.
Hno2 + Rnah2 + H+ => RNA = nar +h2OF
Diazoniumzouten worden gebruikt in organische synthesereacties; Bijvoorbeeld in de reactie van Sandmeyer. In deze reactie treedt de vervanging van een aminogroep voor (h2N-), in een primaire aromatische amine, door de CL-groepen-, BR- en CN-. Om deze aromatische producten te verkrijgen, zijn coupro zouten vereist.
Diazoniumzouten kunnen briljante dakverbindingen vormen die worden gebruikt als kleurstoffen en ook als een kwalitatieve test om de aanwezigheid van aromatische amines te detecteren.
Natrium Azida -eliminatie
Stikstofzuur wordt gebruikt om natriumazide te elimineren3), die potentieel gevaarlijk is vanwege de neiging om te exploiteren.
2 Nan3 + 2 hno2 => 3 n2 + 2 Nee +2 NaOH
Synthese van oxima's
Stikstofzuur kan reageren met ketongroepen om oxima's te vormen. Deze kunnen worden geoxideerd om carboxils of verminderd zuur te vormen om amine te veroorzaken.
Dit proces wordt gebruikt bij de commerciële bereiding van adipinezuur, een monomeer dat wordt gebruikt in de productie van nylon. Het grijpt ook in de productie van polyurethaan en zijn esters zijn weekmakers, voornamelijk in de PVC.
Onder de zoute vorm
Stikstofzuur, in de vorm van natriumnitriet, wordt gebruikt bij de behandeling en het behoud van vlees; Omdat het bacteriegroei voorkomt en kan het reageren met myoglobine, waardoor een donkere rode kleur wordt geproduceerd die vlees aantrekkelijker maakt voor consumptie.
Ditzelfde zout wordt gebruikt, samen met natriumthiosulfaat, bij de intraveneuze behandeling van natriumcyanidevergiftiging.
Referenties
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. Amines. (10e Editie.)). Wiley Plus.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Pubchem. (2019). Stikstofzuur. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Softschools. (2019). Stikstofzuur. Hersteld van: softschools.com
- Wikipedia. (2019). Stikstofzuur. Opgehaald uit: in.Wikipedia.borg
- Royal Society of Chemistry. (2015). Stikstofzuur. Hersteld van: Chemspider.com
- Nieuwe wereld encyclopedie. (2015). Stikstofzuur. Hersteld van: Newworldyclopedia.borg
- Drugsbank. (2019). Stikstofzuur. Hersteld van: Drugsbank.AC
- Chemische formulering. (2018). Hno2. Hersteld van: Quimica -formulering.com
- « Cijfers of indicatoren die praten over educatieve vooruitgang in een land
- Alkyl halogenuros eigenschappen, het verkrijgen van voorbeelden »

