Hafnium

- 1912
- 222
- Irving McClure I
 Metalen hafnio -monster. Bron: Hi-Res Images ofChemical Elements [CC by (https: // creativeCommons.Org/licenties/door/3.0)]
Metalen hafnio -monster. Bron: Hi-Res Images ofChemical Elements [CC by (https: // creativeCommons.Org/licenties/door/3.0)] Wat is Hafnio?
Hij hafnium Het is een overgangsmetaal waarvan de chemische stof HF is en een atoomnummer van 72 heeft. Het is het derde element van groep 4 van de periodiek systeem, die congene is in het titanium en de omloop. Met deze laatste deelt het vele chemische eigenschappen, die samen worden gevestigd in mineralen van de aardkorst.
Op zoek naar de hafnio kijkt waar het zirkonium is, omdat het een bijproduct is van zijn extractie. De naam van dit metaal komt van het Latijnse woord 'hafnia', wiens betekenis de naam is van Kopenhagen, een stad waar het werd ontdekt in zirkoonmineralen en de controverse eindigde met betrekking tot zijn ware chemische aard.
Dit metaal neemt het onderscheid om de laatste van de meest stabiele elementen te zijn die hier op aarde zijn ontdekt; dat wil zeggen, de andere ontdekkingen hebben een reeks ultradansado's, radioactieve en/of kunstmatige isotopen gevormd.
Hafnio -verbindingen zijn analoog aan titanium en circonium, voornamelijk het +4 oxidatienummer, zoals HFCL4, HFO2, Hfi4 en hfbr4. Sommigen van hen leiden de lijst van de meest refractaire materialen die ooit zijn gemaakt, evenals legeringen van grote thermische weerstand en fungeert ook als uitstekende neutronenabsorbenten.
Om deze reden heeft de Hafnio veel deelname aan nucleaire chemie, vooral aan de drukwaterreactoren.
Ontdekking
Overgangsmetaal of zeldzame aardes
De ontdekking van de Hafnio werd omringd door controverses, hoewel het bestaan ervan al sinds 1869 werd voorspeld dankzij het periodiek systeem van Mendeleev.
Het probleem was dat het onder het zirkonium was geplaatst, maar samenviel in dezelfde periode van de elementen van de zeldzame aardes: Lantanoides. Chemici wisten destijds niet of het een overgangsmetaal of een metaal van zeldzame aardes was.
 99,9% hafnium bar. Bron- alchemist-hp (www.Pse-Mendelejew.van), CC BY-SA 2.0, via Wikimedia Commons
99,9% hafnium bar. Bron- alchemist-hp (www.Pse-Mendelejew.van), CC BY-SA 2.0, via Wikimedia Commons De Franse chemicus Georges Urbain, ontdekker van Luthacio, het naburige metaal van de Hafnio, zei in 1911 dat hij Element 72 had ontdekt, die Celtio noemde en verklaarde dat het een metaal van de zeldzame aardes was. Maar drie jaar later werd geconcludeerd dat de resultaten ervan verkeerd waren en dat het alleen een mengsel van Lantanoides had geïsoleerd.
Pas toen de elementen werden besteld door hun atoomnummers, dankzij het werk van Henry Moseley in 1914, dat de buurt tussen Luthate en Element 72 bewijs was van dezelfde groep als titanium en omcursiatiemetalen.
Kan u van dienst zijn: flocculatie: reactie, typen, toepassingen, voorbeeldenDetectie in Kopenhagen
In 1921, na de studies van de atoomstructuur van Niels Bohr en zijn voorspelling van het X -Ray -emissiespectrum voor element 72, werd dit metaal gestopt in de mineralen van de zeldzame aardes; En in plaats daarvan concentreerde zijn zoektocht op circoniummineralen, omdat beide elementen verschillende chemische eigenschappen moesten delen.
Deense chemicus Dirk Coster en Hongaarse chemicus Georg von Hevesy in 1923 herkenden eindelijk het voorspelde spectrum door Niels Bohr in zirkoonmonsters uit Noorwegen en Groenland. Nadat ze de ontdekking in Kopenhagen hebben gedaan, noemden ze element 72 bij de Latijnse naam van deze stad: Hafnia, die later 'hafnio' is afgeleid.
Isolatie en productie
Het was echter geen gemakkelijke taak. Hoewel in 1924 een methode werd bedacht door fractionele herkristallisatie om hafnio -tetrachloride te verkrijgen, hfcl4, Het waren de Nederlandse chemicaliën Anton Eduard van Arkel en Jan Hendrik de Boer die hem terugbladen tot de metalen hafnium.
Om dit te doen, de HFCL4 Het onderging een reductie met behulp van metallic magnesium (Kroll -proces):
Hfcl4 + 2 mg (1100 ° C) → 2 mgcl2 + HF
Aan de andere kant, beginnend bij Hafnio Tetrayoduro, HFI4, Dit werd verdampt om een thermische ontleding te lijden op een gloeilamp wolfraam, waarop het metalen hafnium werd afgezet om een polykristallijne uiterlijkbalk te veroorzaken (kristallijn balkproces of arkel-boer-proces):
Hfi4 (1700 ° C) → HF + 2 i2
Hafnio structuur
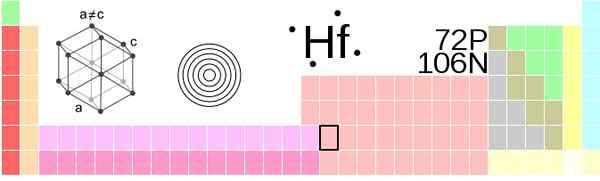 Hafnio -locatie in het periodiek systeem. Fontein: !Origineel: Ahoteseiervector: Sushant Savla, CC BY-SA 3.0, via Wikimedia Commons
Hafnio -locatie in het periodiek systeem. Fontein: !Origineel: Ahoteseiervector: Sushant Savla, CC BY-SA 3.0, via Wikimedia Commons Hafnio, HF -atomen, zijn gegroepeerd in omgevingsdruk op een compact zeshoekig structuurkristal, HCP, net zoals titanium- en zirkoniummetalen doen. Dit hafnio HCP -kristal wordt de a -fase, die constant tot een temperatuur van 2030 K blijft, wanneer het een overgang naar de β -fase lijdt, met een kubieke structuur gecentreerd in het lichaam, BCCCCC.
Dit wordt begrepen als de warmte "ontspant", wordt het glas overwogen en daarom proberen HF -atomen zich op een zodanige manier te positioneren dat hun verdichting afneemt. Deze twee fasen zijn voldoende om het polymorfisme van het hafnium te overwegen.
Het presenteert ook een polymorfisme dat afhankelijk is van hoge druk. De α- en β -fasen bestaan bij een druk van 1 atm; Terwijl de ω, zeshoekige maar nog meer verdichte fase dan de gewone HCP, verschijnt wanneer de druk groter is dan 40 GPA. Interessant is dat wanneer de druk blijft toenemen, de β -fase opnieuw verschijnt, de minst dicht.
Kan u van dienst zijn: SELEENHYDRIC AUTE (H2SE): wat is, structuur, eigenschappen, gebruikHafnio -eigenschappen
Fysiek uiterlijk
Zilverwitte vaste stof, die donkere tonen toont als het een laag oxide en nitride heeft.
Molaire massa
178.49 g/mol
Smeltpunt
2233 ºC
Kookpunt
4603 ºC
Dikte
Bij kamertemperatuur: 13,31 g/cm3, Twee keer dichter zijn dan de omloop
Precies op het smeltpunt: 12 g/cm3
Fusiewarmte
27,2 kJ/mol
Verdampingswarmte
648 kJ/mol
Elektronegativiteit
1.3 Op de Pauling -schaal
Ionisatie -energieën
Eerst: 658,5 kJ/mol (HF+ gasvormig)
Ten tweede: 1440 kJ/mol (HF2+ gasvormig)
Derde: 2250 kJ/mol (HF3+ gasvormig)
Warmtegeleiding
23.0 w/(m · k)
Elektrische weerstand
331 nω · m
Mohs hardheid
5.5
Reactiviteit
Tenzij het metaal pula en brandt, vonken vonken bij een temperatuur van 2000 ºC, heeft het geen gevoeligheid voor oxideren of draaien, omdat een dunne laag van zijn oxide het beschermt. In die zin is het een van de meest stabiele metalen. In feite kunnen zuren of sterke basen het oplossen; Met uitzondering van fluorhorinezuur, en halogenen in staat om het te oxideren.
Elektronische configuratie
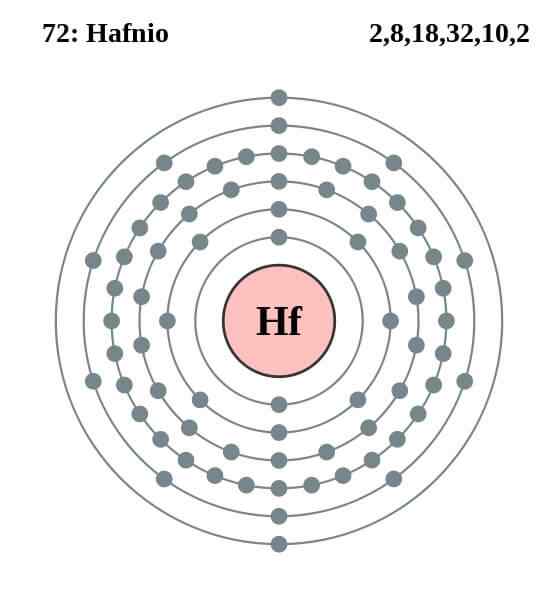 Hafnio elektronische configuratie
Hafnio elektronische configuratie Het atoom van Hafnio heeft de volgende elektronische configuratie:
[XE] 4F14 5 D2 6s2
Dit valt samen met het feit dat het tot groep 4 van het periodiek systeem behoort, samen met het titanium en circonium, omdat het vier Valencia -elektronen heeft in de 5D en 6s orbitalen. Merk op dat de Hafnio geen lantanoide kan zijn, omdat hij zijn volledig volledige 4F -orbitalen heeft.
Oxidatienummers
Dezelfde elektronische configuratie onthult hoeveel elektronen in staat zijn om een hafnio -atoom te verliezen wanneer ze deel uitmaken van een verbinding. Ervan uitgaande dat hij zijn vier elektronen van Valencia verliest, zou hij een tetravalente kation HF zijn4+ (Analogie met jou4+ en ZR4+), En daarom zou een oxidatienummer van +4 hebben.
Dit is in feite de meest stabiele en gebruikelijke van zijn oxidatienummers. Andere minder relevant zijn: -2 (HF2-), +1 (HF+), +2 (HF2+) en +3 (HF3+)).
Isotopen
Hafnio wordt op aarde gepresenteerd als vijf stabiele isotopen en een radioactieve met een zeer grote levenstijd:
-174HF (0,16%, met een halve leven van 2,10vijftien jaren, dus het wordt als praktisch stabiel beschouwd)
-176HF (5,26%)
-177HF (18,60%)
Kan u van dienst zijn: zwakke honken-178HF (27,28%)
-179HF (13,62%)
-180HF (35,08%)
Merk op dat er niet zo'n isotoop als zodanig is die opvalt, en dit wordt weerspiegeld in de gemiddelde atoommassa van de Hafnio, 178.49 uma.
Van alle radioactieve isotopen van de Hafnio, die samen met de inboorlingen in totaal 34, de 178m2HF is het meest controversieel omdat in zijn radioactieve verval gammastraling vrijgeeft, zodat deze atomen kunnen worden gebruikt als een pistool van oorlog.
Gebruik/toepassingen
 Hafnio bedekt met een dunne laag oxide. Bron: Alchemist-HP (talk) (www.Pse-Mendelejew.DE), fal, via Wikimedia Commons
Hafnio bedekt met een dunne laag oxide. Bron: Alchemist-HP (talk) (www.Pse-Mendelejew.DE), fal, via Wikimedia Commons Nucleaire reacties
Hafnio is een vocht -resistent metaal en hoge temperaturen, naast een uitstekende neutronenabsorberende. Om deze reden wordt het gebruikt in drukwaterreactoren, evenals bij de vervaardiging van controlerende balken voor kernreactoren, in wiens coatings ze zijn gemaakt van ultrapuro circu.
Legeringen
Hafnio -atomen kunnen andere metalen kristallen integreren om verschillende legeringen te geven. Deze worden gekenmerkt door vasthoudend en thermisch resistent te zijn, dus ze zijn bestemd voor ruimtelijke toepassingen, zoals bij de constructie van motorrozzels voor raketten.
Aan de andere kant hebben sommige legeringen en vaste verbindingen van Hafnio speciale eigenschappen; zoals hun carbiden en nituros, respectievelijk HFC en HFN, die zeer refractaire materialen zijn. Tantalo en Hafnio Carbide, TA4HFC5, Met een fusiepunt van 4215 ºC is het een van de meest vuurvaste materialen ooit bekend.
Katalyse
Hafnio's metalocenen worden gebruikt als organische katalysatoren voor polymeleenynthese zoals polyethyleen en polystyreen.
Risico's
Het is tot op heden onbekend welke impact de HF -ionen in ons lichaam zouden kunnen hebben4+. Aan de andere kant, omdat ze in de natuur worden gevonden in zirkoniummineralen, wordt niet aangenomen dat ze het ecosysteem van het bevrijden van hun zouten in het milieu kunnen veranderen.
Nu wordt aanbevolen om hafnio -verbindingen zorgvuldig te manipuleren, alsof ze giftig zijn, zelfs als er geen medische studies zijn die bewijzen dat ze schadelijk zijn voor de gezondheid.
Het reële gevaar van de hafnio ligt in de deeltjes van zijn fijngemalen vaste stof, die kunnen branden net wanneer ze in contact komen met de zuurstof van de lucht.
Dit verklaart waarom wanneer het wordt gepolijst, actie die zijn oppervlak schraapt en zuivere metalen deeltjes afgeeft, brandende vonken worden vrijgegeven met een temperatuur van 2000 ºC; dat wil zeggen, de Hafnio presenteert pyroporiciteit, de enige eigenschap die brand of ernstige brandwonden inhoudt.

