Hydroxyl groep

- 4808
- 1386
- James Dach
We leggen uit wat een hydroxylgroep, de kenmerken, structuur en verschillende voorbeelden zijn
 Chemische structuur van de hydroxylgroep
Chemische structuur van de hydroxylgroep Wat is een hydroxylgroep?
A Hydroxyl groep Het is een functionele groep of onderdeel van andere functionele groepen die aanwezig zijn in veel organische en anorganische verbindingen. Het wordt gevormd door een waterstofatoom en een van zuurstof (vandaar zijn naam).
Hydroxylgroepen zijn meestal gekoppeld aan een koolstofatoom of een ander niet -metalen element zoals onder andere zwavel of fosfor, en zijn een van de belangrijkste functionele groepen in organische chemie.
Deze groep atomen is aanwezig in organische functionele groepen zoals alcoholen, fenolen en carbonzuren, en is degene die elk van deze functionele groepen zijn chemische eigenschappenkenmerken geeft. In verschillende structuren kan het worden weergegeven als -oh of ho-
Kenmerken van hydroxylgroepen
- Het bestaat uit een zuurstofatoom en een van waterstof die aan elkaar is gekoppeld en gekoppeld aan een ander atoom in een molecuul door covalente bindingen.
- Het verband tussen het waterstof- en zuurstofatoom is een polaire binding waarbij zuurstof een negatieve gedeeltelijke belasting en positieve gedeeltelijke belastingwaterstof heeft, waardoor de hydroxylgroep een polaire functionele groep is.
- Het heeft een structuur vergelijkbaar met die van water. Om deze reden zijn veel van de verbindingen die het bevatten meestal oplosbaar in die oplosmiddel.
- Het heeft een waterstof die direct is gekoppeld aan het zuurstofatoom, zodat de hydroxylgroep een waterstofbinding kan vormen waarin het deelneemt als een donorwaterstofgroep.
- Met twee vrije elektronen op het zuurstofatoom, kan de hydroxylgroep twee extra waterstofbruggen vormen die werken als een acceptor van waterstofatomen.
- Je kunt als zuur fungeren door een proton aan een basis te geven. Afhankelijk van de functionele groep waarvan het deel is en het atoom waaraan het direct is gekoppeld, kan de hydroxylgroep verschillende niveaus van zuurgraad vertonen. Bij alcoholen heeft het bijvoorbeeld een PKA van 15 of meer (felzuur dan water), in fenolen varieert het tussen 7 en 10 terwijl in carbonzuren het meestal tussen 4 en 5 is.
- Je kunt ook fungeren als een Lewis -basis, een van zijn elektronenparen doneren om te linken naar een ander proton of een ander Lewis -zuur.
Hydroxylgroepstructuur
Zoals vermeld onder de kenmerken, vormen zuurstof- en waterstofatomen in de hydroxylgroep een polaire covalente binding.
Bovendien vormt het zuurstofatoom een tweede covalente binding met een ander atoom dat deel uitmaakt van een molecuul als alcohol, fenol voor een andere verbinding. De Lewis -structuur van deze groep wordt hieronder gepresenteerd:
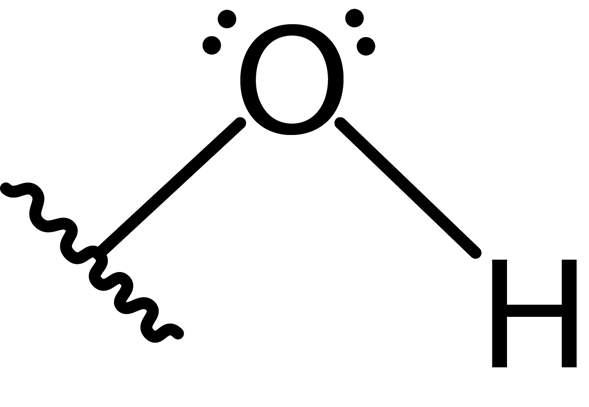
Vanwege de aanwezigheid van de twee paren vrije elektronen op het zuurstofatoom en de twee covalente bindingen, heeft de hydroxylgroep hoekige geometrie met een hoek van ongeveer 104 °, iets lager dan de tetrahedrale hoek. De lengte van de zuurstofhydrogene binding is ongeveer 0.97 Angstrom.
Hydroxylgroep, hydroxylradicaal en hydroxideanion
Het is heel gebruikelijk om de hydroxylgroep te verwarren met hydroxylradicaal en hydroxide -anion, omdat ze allemaal worden gevormd door dezelfde twee atomen, maar deze termen verwijzen niet naar hetzelfde.
Enerzijds verschilt het hydroxylradicaal van de hydroxylgroep waarin het een vrije radicaal is met een oneven aantal valentie -elektronen, en is ook niet gekoppeld aan een ander atoom of groep atomen (daarom wordt het gratis verteld).
Ondanks deze verschillen gebruiken veel mensen ten onrechte de hydroxylradicale term om naar de hydroxylgroep te verwijzen wanneer aanwezig in een molecuul.
Hydroxide -anion daarentegen is een ion met een negatieve belasting gevormd door waterstof en zuurstof, terwijl de hydroxylgroep een neutrale groep is.
Hoewel de hydroxylgroep altijd is gekoppeld aan een molecuul door middel van een covalente binding, hebben verbindingen die hydroxide -ionen bevatten ionenbinding tussen dit en wat metaal zoals natrium, lithium of kalium.
Kan u van dienst zijn: wat zijn de anode en de kathode?Voorbeelden van hydroxylgroep
Alcohol
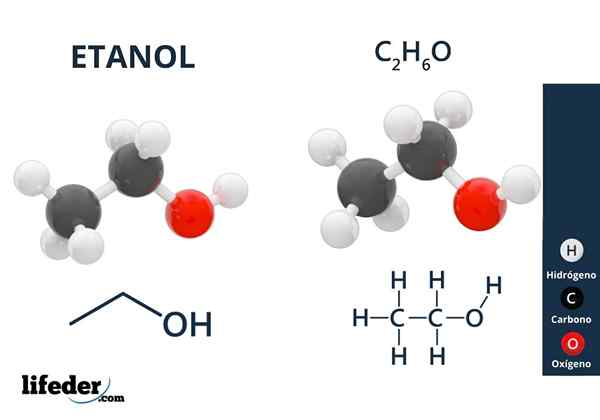 Ethanol
Ethanol Alcoholen hebben hydroxylgroepen gekoppeld aan een alifatische koolstof. Voorbeelden van alcoholen zijn:
- Methyl alcohol.
- Ethanol.
- Isopropylalcohol.
Fenolen
De fenolen worden gekenmerkt door een hydroxylgroep direct te hebben gekoppeld aan een aromatische ring. Enkele voorbeelden van veel voorkomende fenolen zijn:
- Fenol.
- Alfa en Beta-NaFtol.
- Ortho, doel en voor Cresol.
Koolhydraten
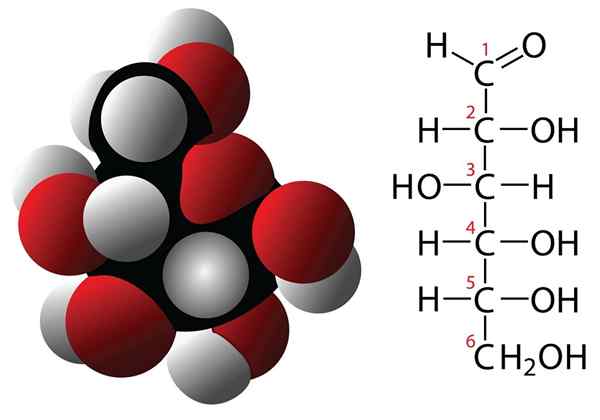 Glucose- en moleculaire formulemolecuul
Glucose- en moleculaire formulemolecuul Koolhydraten zijn verbindingen met 3 of meer koolstofatomen die worden gekenmerkt door een empirische formule te hebben gevormd door koolstofatomen en watermoleculen. Deze verbindingen hebben vaak meerdere hydroxilli -groepen waardoor ze zeer oplosbaar zijn in water. Enkele voorbeelden van koolhydraten zijn:
- Glucose.
- Fructose.
- Sacharose.
Carbonzuren
De carboxylfunctionele groep aanwezig in carbonzuren komt overeen met een van de meest zure functionele groepen die een organisch molecuul kan hebben. Deze verbindingen zijn meestal zwakke zuren bij het vergelijken van ze met sommige minerale zuren, maar ze kunnen aanzienlijk zuur worden, afhankelijk van hun structuur.
De zuurgraad van de carboxylgroep is te wijten aan de aanwezigheid van een hydroxylgroep gekoppeld aan een carbonylgroep, die de negatieve belasting stabiliseert van het anion dat zich vormt wanneer het hydroxyl zijn proton oplevert. Enkele voorbeelden van carbonzuren zijn:
- Azijnzuur.
- Benzoëzuur.
- Trifluorazijnzuur.
Sulfonzuren
Sulfonzuren zijn organische verbindingen die worden gevormd door de reactie tussen sommige organische verbindingen en zwavelzuur of zwaveldioxide. Dit soort verbindingen hebben een hydroxylgroep en zijn in het algemeen vrij sterke zuren, vergelijkbaar met zwavelzuur.
Enkele voorbeelden van sulfonzuren zijn:
- Pentosulfonzuur.
- Ortho, doel en toluensulfonzuur isomeren.
- Benzeulfonzuur.
Anorganische zuren
Hydroxylgroepen verschijnen niet alleen in organische verbindingen. Veel anorganische verbindingen bezitten ze ook, in het bijzonder oxacidzuren. In deze gevallen is de hydroxylgroep direct gekoppeld aan een niet -metaal, meestal verschillend van koolstof.
Enkele voorbeelden van anorganische zuren die hydroxylgroepen hebben, samen met het niet -metaal waaraan het is gekoppeld, zijn:
- Hypochlorzuur, waarin de hydroxylgroep is gekoppeld aan een chlooratoom.
- Zwavelzuur, dat twee hydroxylgroepen heeft gekoppeld aan een zwavelatoom.
- Fosforzuur, waarin de drie hydroxylgroepen zijn gekoppeld aan een fosforatoom.

