Carbonyl -groepskenmerken, eigenschappen, nomenclatuur, reactiviteit
- 1728
- 328
- Nathan Wiegand
Hij Carbonylgroep Het is een organische en geoxygeneerde functionele groep die lijkt op het koolmonoxidegasmolecuul. Het wordt weergegeven als C = O, en hoewel het als organisch wordt beschouwd, kan het ook worden gevonden in anorganische verbindingen; Zoals koolzuur, h2CO3, of in organometallische verbindingen met CO als een binding.
Het is echter in koolstofchemie, het leven, biochemie en andere analoge wetenschappelijke takken waar deze groep opvalt vanwege zijn enorme belang. Als het niet voor hem was, konden veel moleculen geen interactie met water; Eiwitten, suikers, aminozuren, vetten, nucleïnezuren en andere biomoleculen zouden niet bestaan als het er niet voor was.
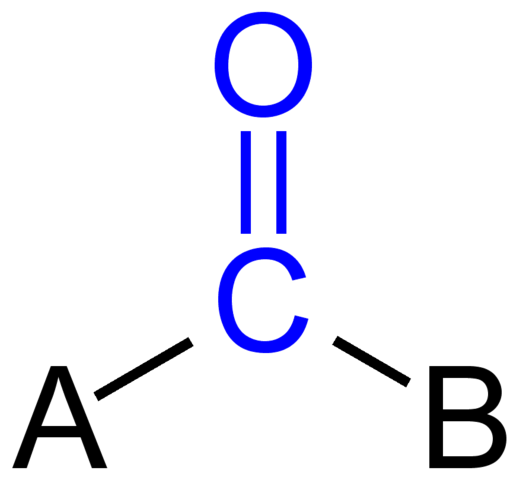
 Carbonylgroep. Bron: Jü [Public Domain]
Carbonylgroep. Bron: Jü [Public Domain] De bovenste afbeelding laat zien hoe deze groep eruit ziet in het algemene skelet van een verbinding. Merk op dat het wordt gemarkeerd door de kleurblauw, en als we de vervangingen a en b (r of r 'hebben verwijderd, even geldig), zou er een molecuul koolmonoxide zijn. De aanwezigheid van deze substituenten definieert een groot aantal organische moleculen.
Als A en B koolstofatomen zijn, zoals metalen of niet -metalen elementen, kunnen organometallische of anorganische verbindingen worden gemaakt. In het geval van organische chemie zullen substituenten A en B altijd zijn of waterstofatomen, koolzuurhoudende lijnen, met of zonder gevolgen, cyclische of aromatische ringen.
Het begint dus te begrijpen waarom de carbonylgroep vrij gebruikelijk is voor degenen die natuurlijke of gezondheidswetenschappen bestuderen; Het is overal, en zonder het zouden de moleculaire mechanismen die in onze cellen plaatsvinden niet optreden.
Als de relevantie ervan kan worden samengevat, zou worden gezegd dat het polariteit, zuurgraad en reactiviteit op een molecuul biedt. Waar een carbonylgroep is, is het meer dan waarschijnlijk dat het molecuul op dat moment een transformatie kan ondergaan. Daarom is het een strategische site om organische synthese te ontwikkelen door oxidaties of nucleofiele aanvallen.
[TOC]
Kenmerken en eigenschappen van de carbonylgroep
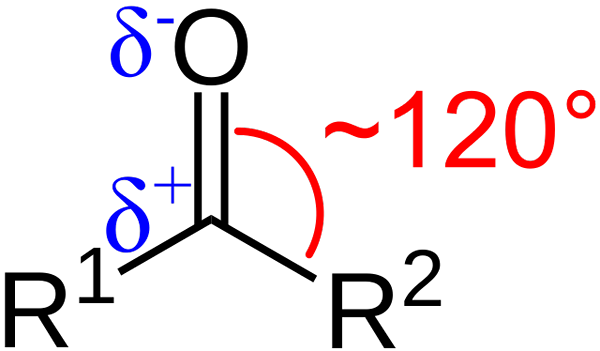 Structurele kenmerken van de carbonylgroep. Bron: Azaline Gomberg [Public Domain].
Structurele kenmerken van de carbonylgroep. Bron: Azaline Gomberg [Public Domain]. Wat zijn de structurele en elektronische kenmerken van de carbonylgroep? Omhoog1 en r2 in plaats van A en B, die bestaat tussen de substituenten en het zuurstofatoom een hoek van 120 ° C; Dat wil zeggen, geometrie rond deze groep is trigonaal plat.
Wat is de geometrie zo2; Aldus zal koolstof drie sp orbitalen hebben2 Om eenvoudige covalente links te vormen met r1 en r2, en een orbitaal P Puur om dubbele binding met zuurstof te vestigen.
Op deze manier wordt uitgelegd hoe er een dubbele binding c = o kan zijn.
Als het beeld wordt waargenomen, zal ook worden gezien dat zuurstof een grotere elektronische dichtheid heeft, Δ-, dan koolstof, δ+. Dit komt omdat zuurstof elektronegatiefer is dan koolstof en daarom elektronische dichtheid "steelt"; En niet alleen voor hem, maar ook voor de substituenten r1 en r2.
Bijgevolg wordt een permanent dipoolmoment gegenereerd, dat van een grotere of mindere omvang kan zijn, afhankelijk van de moleculaire structuur. Waar er een carbonylgroep is, zullen er dipoolmomenten zijn.
Resonantiestructuren
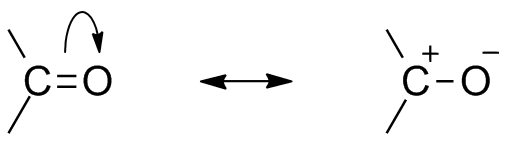 De twee resonantiestructuren voor deze organische groep. Bron: Mfomich [CC0]
De twee resonantiestructuren voor deze organische groep. Bron: Mfomich [CC0] Een ander gevolg van de elektronegativiteit van zuurstof is dat er in de carbonylgroep resonantiestructuren zijn die een hybride definiëren (de combinatie van de twee structuren van het superieure beeld). Merk op dat het elektronenpaar naar het orbitaal kan migreren P van zuurstof, die het koolstofatoom met een positieve gedeeltelijke belasting verlaat; Een carbocatie.
Kan u van dienst zijn: cycloalcanos: eigenschappen, reacties, gebruik, voorbeeldenBeide structuren gebeuren constant, dus koolstof handhaaft een constant tekort aan elektronen; dat wil zeggen, voor kationen die er in de buurt zijn, zullen ze een elektrostatische afstoting ervaren. Maar als het een anion is, of een soort die in staat is elektronen te doneren, zal het een sterke aantrekkingskracht voelen voor deze koolstof.
Dan wordt bekend als de nucleofiele aanval, die zal worden verklaard in een volgende sectie.
Nomenclatuur
Wanneer een compound de groep C = O heeft, wordt gezegd dat het carbonyl is. Dus, afhankelijk van de aard van de carbonylcompound, heeft het zijn eigen nomenclatuurregels.
Hoewel, ongeacht wat het is, deelt iedereen een gemeenschappelijke regel: de C = O heeft een prioriteit in de koolzuurhoudende keten op het moment van het opsommen van koolstofatomen.
Dit betekent dat als er gevolgen zijn, halogeenatomen, stikstoffunctionele groepen, dubbele of drievoudige schakels, geen van hen een kleiner aantal kan dragen dan C = O; Daarom begint de langste keten zo dicht mogelijk bij de carbonylgroep te worden vermeld.
Als er integendeel verschillende C = of in de keten zijn, en een van hen maakt deel uit van een functionele groep van grotere hiërarchie, dan zal de carbonylgroep een grotere locator dragen en wordt vermeld als een OXO -substituent.
En wat er wordt gezegd hiërarchie? Het volgende, van de hoogste tot minor:
-Carbonzuren, RCOOH
-Ester, rCoor '
-Amida, rconh2
-Aldehyde, rcoh (of rcho)
-Cetona, RCOR
R en R 'vervangen door moleculaire segmenten, eindeloze carbonylverbindingen vertegenwoordigd door families hierboven: carbonzuren, esters, amidas, enz. Elk heeft zijn traditionele nomenclatuur of IUPAC geassocieerd.
Reactiviteit
Nucleofiele aanval
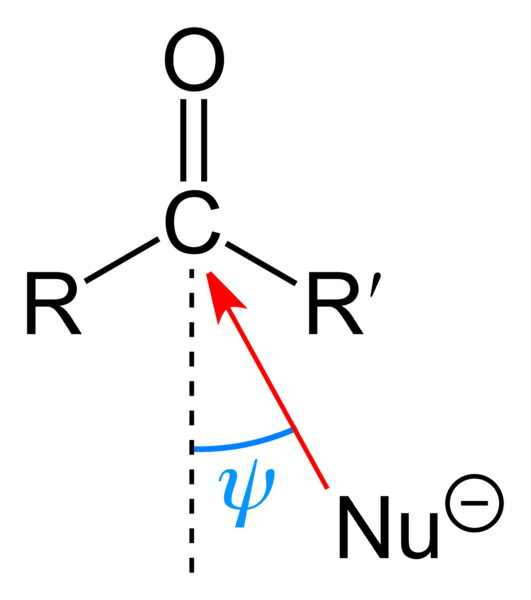 Nucleofiele aanval op de carbonylgroep. Bron: Benjah-bmm27 [Public Domain]
Nucleofiele aanval op de carbonylgroep. Bron: Benjah-bmm27 [Public Domain] Het bovenste beeld toont de nucleofiele aanval die de carbonylgroep heeft geleden. De nucleofiel, nu-, Het kan een anion of een neutrale soort zijn met beschikbare elektronen; Net als de ammoniak, NH3, Bijvoorbeeld. Dit kijkt uitsluitend naar koolstof omdat het volgens resonantiestructuren een positieve gedeeltelijke belasting presenteert.
Positieve belasting trekt NU aan-, die zal proberen een "flank" zodanig te benaderen dat er de minste sterische belemmering is door de substituenten r en r '. Afhankelijk van hoe omvangrijk ze zijn, of de grootte van dezelfde nu-, De aanval zal op verschillende hoeken plaatsvinden ψ; Het kan erg open of gesloten zijn.
Zodra de aanval plaatsvindt, zal een intermediaire verbinding worden gevormd, nu-cr'-o-; dat wil zeggen, zuurstof blijft bij een paar elektronen om NU te laten toegevoegd- aan de carbonylgroep.
Deze negatief geladen zuurstof kan ingrijpen in andere stappen van de reactie; Proton als een hydroxylgroep, OH, of release als een watermolecuul.
Kan u van dienst zijn: Partitiecoëfficiënt: distributie, distributie, toepassingenDe betrokken mechanismen, evenals de producten van de reactie van deze aanval, zijn zeer gevarieerd.
Derivaten
De nublyic agent nu- Het kan veel soorten zijn. Voor elk specifiek voor reageren met de carbonylgroep, verschillende derivaten.
Wanneer deze nucleofiel middel bijvoorbeeld een amine is, is NH2A, iMinas ontstaan, r2C = NR; Als het hydroxylamine is, NH2Oh, resulteert in oxima's, rr'c = noh; Als het het cyanide -anion is, cn-, Cianohydrinas, rr'c (oh) cn, en dus met andere soorten.
Afname
In het begin werd gezegd dat deze groep geoxygeneerd is en daarom roestig is. Dit betekent dat, gezien de omstandigheden, koppelingen kunnen worden verminderd of het zuurstofatoom kunnen verliezen die het vervangen door hydrogenen. Bijvoorbeeld:
C = o => ch2
Deze transformatie geeft aan dat de carbonylgroep werd gereduceerd tot een methyleengroep; Er was waterstofversterking als gevolg van zuurstofverlies. In meer geschikte chemische termen: de carbonylverbinding wordt gereduceerd tot een alkaan.
Als het een cetona, rcor 'is, in aanwezigheid van hydraracina, h2NH2, en een sterk basisomgeving kan worden gereduceerd tot zijn respectieve alkaan; Deze reactie staat bekend als Wolff-Kishner-reductie:
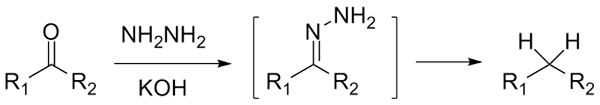 Wolff-Kishner-reductie. Bron: Jü [CC0]
Wolff-Kishner-reductie. Bron: Jü [CC0] Als het reactiemengsel aan de andere kant bestaat uit amalgamaatzink en zoutzuur, staat de reactie bekend als Clemmensen -reductie:
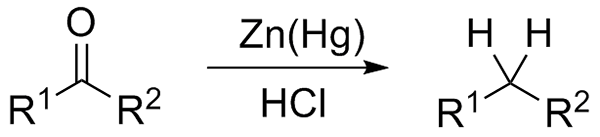 Clemmensen reductie. Bron: Wikimedia Commons.
Clemmensen reductie. Bron: Wikimedia Commons.
Acetal en ceal training
De carbonylgroep kan niet alleen nucleofiele middelen toevoegen-, Maar in zure omstandigheden kan het ook reageren met alcoholen via vergelijkbare mechanismen.
Wanneer een aldehyde of cetona gedeeltelijk reageert met een alcohol, komen hemiacetalen of hemicetalen respectievelijk afkomstig. Als de reactie volledig wordt uitgevoerd, zijn de producten acetalen en ketalen. De volgende chemische vergelijkingen vatten de nieuw genoemde samen:
Rcho + r3Oh g rchoh (of3) (Hemiacetal) + R4Oh g rch (of3) (Of4) (Acetal)
Rcor2 + R3Oh g rcor2(Oh) (of3) (Hemical) + R4Oh g rcor2(Of3) (Of4) (Ketal)
De eerste reactie komt overeen met de vorming van hemiacetalen en acetalen uit een aldehyde, en de tweede van hemicetalen en ketalen uit een keton.
Deze vergelijkingen zijn niet eenvoudig genoeg om de vorming van deze verbindingen te verklaren; Voor een eerste benadering van het onderwerp is het echter voldoende om te begrijpen dat alcoholen worden toegevoegd en dat hun zijketens R (r (r3 en r4) Ze zijn gekoppeld aan carbonyl koolstof. Dat is waarom of of3 en of4 Naar het eerste molecuul.
Het belangrijkste verschil tussen een acetaal en ketaal, is de aanwezigheid van het waterstofatoom dat is gekoppeld aan koolstof. Merk op dat de keton deze waterstof mist.
Jongens
Zeer vergelijkbaar zoals uitgelegd in de sectie Nomenclatuur voor de Carbonyl -groep, zijn de typen gebaseerd op wat de substituenten A en B, of R en R 'zijn. Daarom zijn er structurele kenmerken die een reeks carbonylverbindingen delen voorbij alleen de volgorde of type links.
Er is bijvoorbeeld een melding gemaakt van het principe van analogie tussen deze groep en koolmonoxide, C≡O. Als het molecuul verstoken is van waterstofatomen en als er ook twee C = O -terminals zijn, is het een koolstofoxide, cNOF2. Voor n gelijk aan 3, zul je hebben:
Kan u van dienst zijn: isóbarosO = C = C = C = O
Dat is alsof er twee C≡O -moleculen zijn gekoppeld en gescheiden door een koolstof.
Carbonylverbindingen kunnen niet alleen afkomstig zijn van CO -gas, maar ook van koolzuur, h2CO3 of oh- (c = o) -oh. Hier vertegenwoordigen de twee OH R en R ', en het vervangen van een van hen, of hun hydrogenen, worden koolstofzuurderivaten verkregen.
En dan zijn er derivaten van carbonzuren, RCOOH, verkregen door R -identiteiten te veranderen, of H te vervangen door een ander atoom of keten R '(die aanleiding zou geven tot een ester, rCoor').
Hoe het te identificeren in aldehydos en ketonen
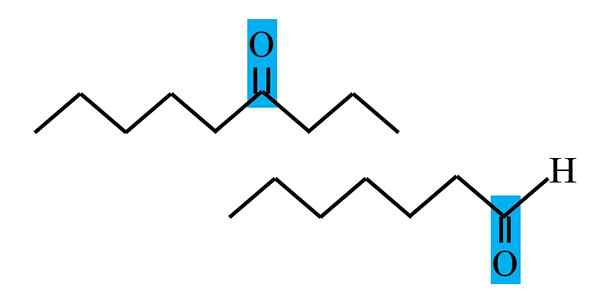 Differentiatie van de keton en aldehyde van een structurele formule. Bron: Gabriel Bolívar.
Differentiatie van de keton en aldehyde van een structurele formule. Bron: Gabriel Bolívar. Zowel aldehydos als ketonen hebben de aanwezigheid van de carbonylgroep gemeen. De chemische en fysische eigenschappen zijn te wijten. Hun moleculaire omgevingen zijn echter niet gelijk in beide verbindingen; In het eerste is hij in een terminale positie en in de seconden, overal in de keten.
In de bovenste afbeelding bevindt de carbonylgroep zich bijvoorbeeld in een blauwachtige doos. In de ketonen moet er naast dit doos een ander koolstof- of ketensegment zijn (ondersteboven); Terwijl in de aldehyden, kan er alleen een waterstofatoom zijn (hieronder).
Als de C = O zich aan het ene uiteinde van de keten bevindt, zal dit een aldehyde zijn; Dat is de meest directe manier om het te onderscheiden van een cetona.
ID kaart
Maar hoe u experimenteel kunt weten of een onbekende verbinding een aldehyde of een keton is? Er zijn talloze methoden, van spectroscopische (infraroodstraling absorptie, IR) of organische kwalitatieve tests.
Wat betreft kwalitatieve essays, deze zijn gebaseerd op reacties die wanneer positief wordt gegeven, de analist een fysieke reactie zal waarnemen; Een kleurverandering, warmteafgifte, bellenvorming, enz.
Bijvoorbeeld het toevoegen van het monster een zure oplossing van K2Cr2OF7 De aldehyde zal worden omgezet in carbonzuur, waardoor de kleur van de oplossing van oranje naar groen verandert (positieve test). Ondertussen reageren de ketonen niet en daarom observeert de analist geen kleurverandering (negatieve test).
Een andere proef is om het Tollens -reagens te gebruiken, [Ag (NH3))2]+, zodat het aldehyde de kationen Ag vermindert+ tot metaal zilver. En het resultaat: de vorming van een zilveren spiegel aan de onderkant van de testbuis waar het monster werd geplaatst.
Hoofdvoorbeelden
Ten slotte wordt een reeks voorbeelden van carbonylverbindingen vermeld:
-Ch3COOH, azijnzuur
-HCOOH, mierenzuur
-Ch3Bedekken3, Propanona
-Ch3Bedekken2Ch3, 2-butanon
-C6H5Bedekken3, acetofenon
-Ch3Cho, Etanal
-Ch3Ch2Ch2Ch2Cho, Pentanal
-C6H5Cho, Benzaldehyde
-Ch3Conh2, acetamide
-Ch3Ch2Ch2Cooch3, Propylacetaat
Nu, als er voorbeelden van verbindingen worden aangehaald die gewoon deze groep bezitten, zou de lijst bijna eindeloos zijn.
Referenties
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5e editie. Redactionele addison-wesley inter-Amerikaan.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. Amines. (10e editie.)). Wiley Plus.
- Reid Danielle. (2019). Carbonyl Group: Properties & Overzicht. Studie. Hersteld van: studie.com
- Sharleen Agvateesiri. (5 juni 2019). De carbonylgroep. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Wiki Kids Ltd. (2018). Carbonylverbindingen. Hersteld van: eenvoudigweg.Wetenschap
- Toppr. (S.F.)). Nomenclatuur en structuur van carbonylgroep. Hersteld van: toppr.com
- Clark J. (2015). Oxidatie van aldehyden en ketonen. Hersteld van: chemguide.co.Uk
- « José Rubén Romero Biography, Style, Works
- Koolstof 12 nucleaire notatie, geschiedenis, opmerkingen »

