Glutathion -kenmerken, structuur, functies, biosynthese
- 1957
- 47
- Dewey Powlowski
Hij Glutathion ((GSH) Het is een klein tripeptidemolecuul (met slechts drie niet -eiwitafval) dat deelneemt aan veel biologische fenomenen zoals enzymatische mechanica, macromoleculen biosynthese, intermediair metabolisme, zuurstoftoxiciteit, intracellulair transport, etc.
Dit kleine peptide, aanwezig bij dieren, in planten en in sommige bacteriën, wordt beschouwd als een "buffer" oxide-reductor, omdat het een van de belangrijkste verbindingen met een laag molecuulgewicht is die zwavel bevat en toxiciteit mist geassocieerd met cysteïneresten.
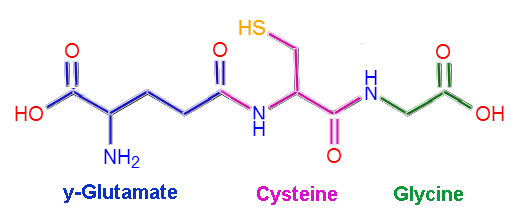
 Moleculaire structuur van glutathione (Bron: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Moleculaire structuur van glutathione (Bron: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) Sommige ziekten bij mensen zijn geassocieerd met het tekort aan specifieke enzymen van glutathionmetabolisme, en dit is te wijten aan hun meerdere functies bij het behoud van homeostase van het lichaam.
Ondervoeding, oxidatieve stress en andere pathologieën die door mensen worden geleden, kunnen worden aangetoond als een drastische afname van glutathion, dus het is soms een goede indicator voor de gezondheidstoestand van lichaamssystemen.
Voor planten is glutathion op dezelfde manier een onmisbare factor voor zijn groei en ontwikkeling, omdat het ook functioneert in meerdere biosynthetische routes en essentieel is voor celontgifting en interne homeostase, waar het fungeert als een krachtige antioxidant.
[TOC]
Kenmerken
De eerste studies uitgevoerd met betrekking tot de subcellulaire locatie van glutathion toonden aan dat deze aanwezig is in de mitochondria. Vervolgens werd het ook waargenomen in het gebied dat overeenkomt met de nucleaire matrix en in peroxisomen.
Momenteel is het bekend dat het compartiment waar de concentratie ervan overvloediger is, in cytosol is, omdat er actief wordt geproduceerd en getransporteerd naar andere celcompartimenten zoals mitochondria.
In zoogdiercellen ligt de concentratie van glutathion in het bereik van millimolen, terwijl in het bloedplasma de verminderde vorm (GSH) wordt gevonden in micromolaire concentraties.
Deze intracellulaire concentratie lijkt op de concentratie van glucose, kalium en cholesterol, onmisbare elementen voor cellulaire structuur en metabolisme.
Sommige organismen hebben analoge moleculen of glutathionvarianten. Protozoaire parasieten die zoogdieren beïnvloeden, hebben een vorm die bekend staat als "Tripanotion" en in sommige bacteriën wordt deze verbinding vervangen door andere gesulfuriseerde moleculen zoals thiosulfaat en glutamilcysteïne.
Bepaalde soorten planten hebben, naast glutathione, homologe moleculen die andere afval dan glycine hebben aan het C-terminale uiteinde (homoglutatie), en die worden gekenmerkt door functies te presenteren die vergelijkbaar zijn met die van de tripéptide in kwestie in kwestie.
Ondanks het bestaan van andere verbindingen die vergelijkbaar zijn met glutathion in verschillende organismen, is dit een van de "thiolen" die intracellulair in meer concentratie is.
De hoge relatie die normaal bestaat tussen de verminderde vorm (GSH) en de geoxideerde vorm (GSSG) van glutathion is een ander onderscheidend kenmerk van deze molecuul.
Structuur
Gutatie of L-Duitse-glutamil-ciste-glycine, zoals de naam al aangeeft, bestaat uit drie aminozuurafval: L-glutamaat, L-cysteïne en glycine. Cysteïne en glycineresten binden aan elkaar door gemeenschappelijke peptidekoppelingen, dat wil zeggen tussen de a-carboxylgroep van het ene aminozuur en de α-amino-groep van het andere.
Het verband tussen glutamaat en cysteïne is echter niet typisch voor eiwitten, omdat het optreedt tussen het γ-carboxylgedeelte van de groep R van het glutamaat en de a-aminogroep van de cysteïne, dus deze link is dat het γ wordt genoemd koppeling.
Dit kleine molecuul heeft een molaire massa van iets meer dan 300 g/mol en de aanwezigheid van de γ -link lijkt cruciaal te zijn voor de immuniteit van dit peptide tegen de werking van veel aminopeptidase -enzymen.
Kan u van dienst zijn: solidariteit tussen soortenFunctie
Zoals gezegd, is glutathion een eiwit dat deelneemt aan tal van cellulaire processen van dieren, planten en bepaalde prokaryoten. In die zin kan uw algemene deelname worden benadrukt in:
-Eiwitsynthese en afbraakprocessen
-De vorming van ribonucleotide -voorlopers van DNA
-De regulering van de activiteit van sommige enzymen
-De bescherming van cellen in aanwezigheid van reactieve zuurstofspecies (ROS) en andere vrije radicalen
-Signaaltransductie
-Genetische expressie en in
-Geprogrammeerde celapoptose of dood
Co -enzym
Er is ook vastgesteld dat glutathione werkt als co-enzym in veel enzymatische reacties, en dat een deel van het belang ervan verband houdt met wat het vermogen heeft om aminozuren te transporteren in de vorm van γ-glutamil aminozuren intracellulair.
Het glutathion dat de cel kan verlaten (wat dit in zijn verminderde vorm doet) is in staat om deel te nemen aan oxide-reductiereacties in de buurt van het plasmamembraan en de omringende celomgeving, die schadecellen beschermt voor verschillende soorten oxiderende middelen.
Cysteïne -opslag
Deze tripéptido werkt ook als een cysteïne -opslagbron en draagt bij aan het behoud van de verminderde toestand van de eiwitsulfhydhylgroepen in de hemo -groep van de hemo -groep van de eiwitten die genoemde cofactor bevatten.
Eiwitvouwen
Bij deelname aan eiwitvouwen lijkt het een belangrijke functie te hebben als een reductiemiddel van disulfidebruggen die onjuist zijn gevormd in eiwitstructuren, wat meestal te wijten is aan blootstelling aan oxidatiemiddelen zoals zuurstof, waterstofperoxide, peroxinitriet en sommige superoxiden.
Functie in erytrocyten
In erytrocyten, de verminderde glutathione (GSH) geproduceerd door het enzymreductase glutathion peroxidase, dat geoxideerd water en glutathion (GSSG) produceert.
De ontleding van waterstofperoxide en daarom de preventie van zijn accumulatie in erytrocyten, verlengt de levensduur van deze cellen, omdat het de oxidatieve schade vermijdt die kan optreden in het celmembraan en die kan eindigen in hemolyse.
Xenobiotisch metabolisme
Glutathion is ook een belangrijke hoofdrolspeler in het xenobiotische metabolisme, dankzij de S-transferaseful glutathionenzymwerking die glutathion-conjugaten genereert die vervolgens intracellulair kunnen worden gemetaboliseerd.
Het is wijs.
Oxidatieve toestand van cellen
Aangezien glutathion in twee vormen bestaat, een verminderde en één geoxideerde, bepaalt de relatie tussen beide moleculen de redox -toestand van cellen. Als de GSH/GSSG -verhouding groter is dan 100, worden de cellen als gezond beschouwd, maar als deze bijna 1 of 10 is, kan dit een indicator zijn dat de cellen zich in een toestand van oxidatieve stress bevinden.
Biosynthese
Tripideide-glutathie wordt gesynthetiseerd in cellulaire, zowel planten als dieren, door de werking van twee enzymen: (1) de γ-glutamilcistine-synthetase en (2) de synthetase glutathione (GSH synthetase), terwijl de afbraak of "decompositie" afhankelijk is van de werking van het γ-glutamil transpeptidase-enzym.
In plantenorganismen wordt elk van de enzymen gecodeerd door een enkel gen en defecten in een van de eiwitten of hun coderingsgenen kunnen letaliteit in de embryo's veroorzaken.
Kan u van dienst zijn: fylogenieIn de mens, net als bij andere zoogdieren, is de hoofdplaats van synthese en export van glutathionvraag.
Synthese van novo van glutathione, hun regeneratie of recycling, vereisen energie van ATP.
Verminderde glutathione (GSH)
Het gereduceerde glutathion is afgeleid van de aminozuren-glycine, glutamaat en cysteïne, zoals reeds vermeld, en de synthese ervan begint met de activering (met behulp van ATP) van de y-carboxylgroep glutamaat (van de groep R) om een acylfosfaat-intermediair te vormen, die het wordt aangevallen door de a-amino-groep van de cysteïne.
Deze eerste condensatiereactie van twee aminozuren wordt gekatalyseerd door de y-glutamilcisteïne synthetase en wordt meestal beïnvloed door de intracellulaire beschikbaarheid van de aminozuren glutamaat en cysteïne.
De aldus gevormde dipéptide wordt vervolgens gecondenseerd met een glycinemolecuul dankzij de werking van de synthetase gsh. Tijdens deze reactie vindt een ATP-activering van de a-carboxylgroep van het cysteïne ook plaats om een fosfaatacyl te vormen en zo de voorkeur geven aan de reactie met het glycineresidu.
Gesoxideerd glutathion (GSSG)
Wanneer de verminderde glutathionen deelnemen aan oxide-reductiereacties, bestaat de geoxideerde vorm eigenlijk uit twee glutathionmoleculen die aan elkaar zijn bevestigd door disulfurbruggen; Het is om deze reden dat de roestige vorm wordt afgekort met het acroniem "GSSG".
De vorming van de geoxideerde soort glutathione hangt af van een enzym dat bekend staat als peroxidase of GSH -peroxidase, een peroxidase dat een selenocysteïne bevat (een cysteïneridu dat in plaats van een zwavelatoom een van Selenium heeft) in zijn Plaats de aanwinst.
De interconversie tussen geoxideerde en verminderde vormen wordt gegeven dankzij de deelname van een GSSG -reductase of reductase glutathion.
Voordelen van uw inname
Glutathion kan orale, actuele, intraveneuze, intranasaal of verneveld worden toegediend om hun systemische concentratie bij patiënten met oxidatieve stress te vergroten, bijvoorbeeld, bijvoorbeeld.
Kanker
Onderzoek uitgevoerd met betrekking tot de orale glutathion -toediening suggereert dat de inname ervan de risico's van de conditie van orale kanker kan verminderen en dat, samen met oxidatieve chemotherapeutica, de negatieve effecten van therapie bij kankerpatiënten vermindert.
Hiv
In het algemeen hebben patiënten die geïnfecteerd zijn met het verworven immunodeficiëntievirus (HIV) intracellulaire glutathione tekortkomingen zowel in rode bloedcellen als in T -cellen en monocyten, die hun juiste functioneren aanmelden.
In een studie uitgevoerd door Morris en medewerkers werd aangetoond dat de toevoer van glutathione naar macrofagen van HIV -positieve patiënten de functie van deze cellen aanzienlijk verbeterde, vooral in het licht van infecties met opportunistische pathogenen zoals zoals zoals opportunistische pathogenen zoals zoals M. tuberculose.
Spieractiviteit
Andere studies hebben te maken met de verbetering van de contractiele activiteit van spieren, antioxidatieve verdediging en oxidatieve schade veroorzaakt als reactie op ischemie/reperfusie -laesies na de orale toediening van GSH tijdens fysieke weerstandstraining.
Leverpathologieën
Het is op zijn beurt geacht dat de intraveneuze inname of toediening functies heeft bij het voorkomen van de voortgang van sommige soorten kanker en bij de vermindering van celschade die optreden als gevolg van bepaalde leverpathologieën.
Kan u van dienst zijn: essentiële vetzuren: functies, belang, nomenclatuur, voorbeeldenAntioxidant
Hoewel niet alle gerapporteerde studies zijn uitgevoerd bij menselijke patiënten, maar meestal zijn dit tests in diermodellen (over het algemeen muizen), stellen de resultaten verkregen in sommige klinische onderzoeken de effectiviteit van de exogene glutathion als antioxidant.
Om deze reden wordt het gebruikt voor de behandeling van cataract en glaucoom, als een "anti-veroudering" product, voor de behandeling van hepatitis, talrijke hartaandoeningen, geheugenverlies en voor de versterking van het immuunsysteem, en voor de zuivering daarna vergiftiging met zware metalen en drugs.
"Absorptie"
De glutathión die exogeen wordt toegediend, kan niet de cellen binnenkomen tenzij het wordt gehydrolyseerd tot hun samenstellende aminozuren. Daarom is het directe effect van de toediening (orale of intraveneuze) van deze verbinding de toename van de intracellulaire concentratie van GSH dankzij de bijdrage van de noodzakelijke aminozuren voor hun synthese, die effectief naar het cytosol kunnen worden getransporteerd.
Bijwerkingen
Hoewel wordt overwogen dat de inname van glutathion "veilig" of onschadelijk is, zijn niet genoeg studies naar hun bijwerkingen uitgevoerd.
Van de weinige gerapporteerde studies is het echter bekend dat het negatieve effecten kan hebben die het gevolg zijn van interactie met andere geneesmiddelen en die schadelijk kunnen zijn voor de gezondheid in verschillende fysiologische contexten.
Als het op de lange termijn wordt ingenomen, lijkt het erop dat zinkniveaus in overmatige daling werken.
Referenties
- Allen, J., & Bradley, r. (2011). Effecten van orale glutathion. The Journal of Alternative and Complementary Medicine, 17(9), 827-833.
- Conklin, K. NAAR. (2009). Antioxidanten in de voeding tijdens chemotherapie op kanker: impact op chemotherapeutische effectiviteit en ontwikkeling van bijwerkingen. Voeding en kanker, 37(1), 1-18.
- Meister, een. (1988). Glutathione -metabolisme en de selectieve aanpassing ervan. The Journal of Biological Chemistry, 263(33), 17205-17208.
- Meister, een., & Anderson, m. EN. (1983). Glutathion. Ann. Rev Biochem., 52, 711-760.
- Morris, D., Oorlog, c., Khurasany, m., Guilford, f., & Saviola, B. (2013). Glutathiona suppletie verbetering macrofaagfuncties in HIV. Journal of Interferon & Cytokine Research, elf.
- Murray, r., Bender, D., Botham, k., Kennelly, p., Rodwell, V., & Weil, p. (2009). Harper's geïllustreerde biochemie (28e ed.)). McGraw-Hill Medical.
- Nelson, D. L., & Cox, m. M. (2009). Lehninger -principes van biochemie. Omega -edities (5e ed.)). https: // doi.org/10.1007/S13398-014-0173-7.2
- Noctor, g., Mhamdi, a., Chaouch, s., Han, en. Je., Neukermans, J., Marquez-Garcia, B.,... foyer, c. H. (2012). Glutathione in planten: een geïntegreerd overzicht. Plant, cel en omgeving, 35, 454-484.
- Pizzorno, J. (2014). Glutathion! Onderzoeksmedicijn, 13(1), 8-12.
- Qanungo, s., Sterke, D. W., Pai, h. V, myyal, j. J., & Nieminen, tot. (2007). Glutathion. The Journal of Biological Chemistry, 282(25), 18427-18436.
- Ramires, p. R., & Ji, l. L. (2001). Glutathiona-suppletie en training verhoogt de myocardiale weerstand tegen ischemie-reperfusie in vivo. Ann. J. Fysiol. Hartcirc. Fysiol., 281, 679-688.
- Sies, h. (2000). Glutathione en zijn rol in cellulaire functies. Free Radical Biology & Medicine R, 27(99), 916-921.
- Wu, g., Fang, en., Yang, s., Lupton, J. R., & Turner, n. D. (2004). Glutathione -metabolisme en de implicaties ervan voor de gezondheid. American Society for Nutritional Sciences, 489-492.
- « Uitgave van gelijkmatig versnelde rechtlijnige bewegingskarakteristieken, formules
- Kenmerken, typen, functies »

