Galvanoplastiek

- 1793
- 360
- Dewey Powlowski
We leggen uit waar Galvanoplastiek uit bestaat, ook wel elektrodepositie genoemd, hoe is het proces, praktische voorbeelden en zijn toepassingen.
 Galvanoplastiek van een lepel
Galvanoplastiek van een lepel Wat is galvanoplastiek?
Galvanoplastiek of elektrodepositie is een elektrochemische techniek die bestaat, zoals de naam al doet vermoeden, in het afzetten van lagen van metalen bij het ontvangen van objecten; Dat wil zeggen, ze bedekken van een metalen deksel, waarvan de dikte tussen 5-20 μm varieert.
Deze techniek staat ook bekend als elektrochapado of elektrolytisch vergulde, als een elektrolytisch medium dat is samengesteld uit metaalionen van het metaal dat gewenst is om te deponeren, is onmisbaar voor de implementatie. Daarom hebben we, als we een koperen (koper) willen, in koper oplosbare zouten nodig hebben, zoals kopersulfaat, opgelost in water.
De vorige redenering is van toepassing op elk ander metaal: een gouden elektrolytisch vergulde vereist goudzouten, meestal gouden cyaniden, die zeer giftig kunnen worden. Sommige objecten, zoals eetgerei, kunnen dus worden bedekt met goud om meer waarde en adel toe te wijzen.
Maar galvanoplastiek gaat verder dan esthetiek: ze worden verleend. Het maakt ook het mogelijk om natuurlijke hulpbronnen te besparen, omdat het niet nodig is om grote hoeveelheden metaal uit te geven voor coatings.
Galvanoplastiekproces
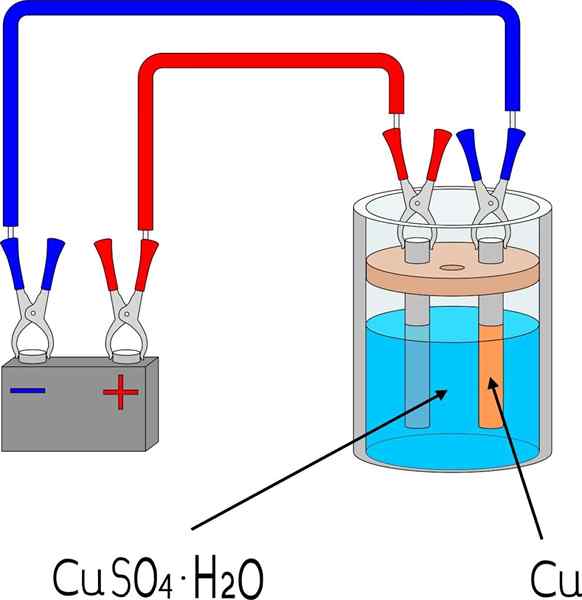 Koper -elektrodepositie in een kopersulfaatbadkamer
Koper -elektrodepositie in een kopersulfaatbadkamer Items
Om een metaal op een oppervlak te elektroden, zijn sommige basiselementen nodig, waarvan de afmetingen en de modus variëren, afhankelijk van de batch van objecten die moeten worden bedekt.
In de bovenste afbeelding wordt bijvoorbeeld kleine schalen koperen elektrode getoond, reproduceerbaar in elk laboratorium of ruimte.
Elektrolytisch medium
Ten eerste is een elektrolytmedium van het metaal naar elektrodeposit nodig. Kopersulfaatzout, cuo4, Het is erg oplosbaar in water, dus het brengt IONS cu2+ die dan worden gereduceerd tot atomen cu0. Deze atomen zijn die die op het ontvangende oppervlak worden geassembleerd om metalen kristallen te leiden.
Het elektrolytische medium is onmisbaar dat het circuit werkt en ionische belastingen kunnen bewegen of mobiliseren naar het gebied waar elektrodepositie optreedt.
Elektroden
De elektroden zijn de oppervlakken waarop de elektrodepositie plaatsvindt vanaf de chemische basis. In eenvoudige termen zijn er twee elektroden: de kathode, waar het metaal elektrodepos is; En de anode, waar een chemische reactie plaatsvindt die elektronen schenkt aan de metaalionen die de kathode bedekken.
Het kan u van dienst zijn: urethaan: structuur, eigenschappen, verkrijgen, gebruikDat wil zeggen, de kathode wordt het gewenste stuk. Ondertussen is de anode elk oppervlak waarop een soort zijn elektronen oxideert en doneert aan de kathode. Vaak is de anode gemaakt van hetzelfde metaal dat wordt opgelost in de elektrolytische omgeving. Als er in het midden koper -ionisch is, is de anode in dit geval metallic koper.
Extern circuit
Het externe circuit is een batterij die de initiële elektronen levert die elektrodepositie bevorderen. De aanwezigheid ervan betekent dat de reactie niet spontaan is: elektriciteit is nodig om een chemische verandering te genereren, wat de reductie is van opgeloste metaalionen.
Elektrode -reiniging
Het te bedekken stuk moet volledig schoon zijn. Anders zal de vergulde of coating defect zijn.
Om dit te doen, moet u ervoor zorgen dat het oppervlak volledig hydrofiel is, dat wil zeggen, het heeft geen vet of een vuil. Een manier om dit, na chemisch wassen, te waarborgen, is door het stuk nat te maken met water, en als de vorming van waterdruppels of een niet -uniforme vloeistofdruppel wordt waargenomen, betekent dit dat de elektrode nog niet schoon is.
Reacties en betekenis van elektronen
Galvanoplastiek is een redox -reactie. Daarom: de ene soort moet worden verminderd, terwijl de andere geoxideerde, of vice versa. In het koper hebben we een anode gemaakt van koper en een kathode gemaakt van een metaal (ijzer, zink, tin, enz.)).
Wanneer we de batterij inschakelen, zullen ze elektronen naar de kathode stromen, die negatief begint op te laden.
De negatieve belasting van de kathode trekt kationen aan cu2+ van de elektrolytische omgeving, plaatsvindt de reductie:
Cu2+(AC) +2e- → Cu (s)
Het kan u van dienst zijn: Maillard -reactieDe batterij moet de gedoneerde elektronen herstellen, en ook de ionen Cu moet worden hersteld2+ verminderd om de neutraliteit van de elektrolytische omgeving te behouden. Dit is wanneer de anode in functie komt: koperatomen oxideren:
Cu (s) → Cu2+(AC) +2e-
En de vrijgegeven elektronen worden teruggestuurd naar de batterij, die op zijn beurt naar de kathode mobiliseert om de elektrodepositie voort te zetten.
De anode wint een positieve belasting, die de SO -ionen aantrekt42- van het elektrolytische medium (zie weer afbeelding).
Dat wil zeggen, de reacties die optreden is de reductie en oxidatie van koper, het metaal dat elektrodepos is:
Cu2+(AC) +2e- → Cu (s)
Cu (s) → Cu2+(AC) +2e-
De anode, van koper, verliest deeg terwijl de kathode, van een ander metaal, bedekt is met een fijne koperen laag.
Voorbeelden van galvanoplastiek
Zilver
Metalen kunnen "elektropleren" zijn, die ze elektrolytisch bedekt van een zilveren laag. Dit is vooral gunstig in elektronische componenten die elektriciteit moeten leiden. Zilver kan elektrodeposita zijn op staal, koper, nikkel en andere metalen.
Met vol
De tinner is de elektrodepositie van tin. Het is erg handig bij de productie van ijzeren blikken, die bedekt zijn met tin om ze bestand te maken tegen corrosie, en dus niet het voedsel of de producten beschadigen die opslaan.
Latijn of bruin
Hoewel een beetje meer uitgebreider, kunnen messing en brons ook elektrodepo's zijn op sommige metalen om hun uiterlijk te verbeteren.
Zink
Zink of zink galvanoplastiek (niet verwarrend met thermische gegalvaniseerd) wordt meestal gebruikt om ijzerweerstand te verlenen tegen corrosie en helderder en aantrekkelijker oppervlakken. De functie ervan is dus esthetisch en tegelijkertijd functioneel, en wordt gevonden in lichaamsdelen zoals de wielen.
Metalen kunststoffen
Kunststoffen, eerder behandeld om een geleidend oppervlak te hebben, kan ook worden bedekt met metaal, wat is alsof ze worden nageleefd aan een vel aluminiumfolie.
Kan u van dienst zijn: Kitasato FlaskGalvanoplastische toepassingen
Galvanoplastiek of elektrodepositie -toepassingen kunnen worden onderverdeeld in functioneel of esthetisch.
Functioneel
 Een dunne elektrodepo's van goud bij de kijkers van de gevallen van astronauten stelt hen in staat om hun ogen te beschermen tegen zonlicht
Een dunne elektrodepo's van goud bij de kijkers van de gevallen van astronauten stelt hen in staat om hun ogen te beschermen tegen zonlicht Een stuk of object coaten is om zijn oppervlak te voorzien van eigenschappen die alleen ontbreekt. Bijvoorbeeld, koper- of gouden elektroodpositie maakt de stukken die ze hebben, dus het is ideaal in elektronische circuits om te profiteren van de eigenschappen van deze metalen, zonder de noodzaak om tonnen goud uit te geven aan de productie van hele en vaste stukken.
Goud daarentegen beschermt warmte- en stralingsoppervlakken. Het is om deze reden dat het op grote schaal wordt gebruikt in de satellieten en in de helmen van de astronauten, omdat het het zonlicht weerspiegelt dat aldus hun ogen of snel heet is.
Chrome of verbogen staal zijn zeer resistent tegen corrosie, dankzij deze metalen lagen. Dat is de reden waarom galvanoplastiek in de industrie wordt gebruikt om metalen gevoelig te beschermen voor CorroD.
Esthetiek
Metallic fineer schijnen. Zink, nikkel en chroom worden voor dit doel veel gebruikt. Ook zijn goud en zilver elektrodepo's in ringen, ketens, armbanden, chokers, hellingen, enz., En daarom vindt de galvanoplastiek veel toepassingen in sieraden en versieringen om het beeld en de prestige van deze kleding te verbeteren.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Wikipedia. (2021). Elektroplateren. Opgehaald uit: in.Wikipedia.borg
- Chris Woodford. (28 juli 2020). Hoe elektroplating werkt. Opgehaald uit: explinThatStuff.com
- Rob Snyder. (S.F.)). Elektrodepositie op nanoschaal. STEM Education Institute. [PDF]. Hersteld van: nanoschaal.UNL.Edu
- Elsevier B.V. (2021). Elektrodepositie. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- Vaishali Mittal. (10 december 2020). Elektroplateren. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Singh Davneet. (9 juni 2020). Verschillende soorten electropling. Hersteld van: Teachoo.com
- Helmestine, Anne Marie, pH.D. (26 augustus 2020). Wat is elektropaniseren en hoe werkt het? Hersteld van: Thoughtco.com

