Samenhangkracht
- 1650
- 419
- James Dach
Wat zijn cohesiekrachten?
De samenhangkrachten Het zijn de intermoleculaire aantrekkingskrachten die sommige moleculen bij andere behouden. Afhankelijk van de intensiteit van cohesiekrachten, bevindt zich een stof in vaste, vloeibare of gasvormige toestand. De waarde van cohesiekrachten is een intrinsieke eigenschap van elke stof.
Deze eigenschap is gerelateerd aan de vorm en structuur van de moleculen van elke stof. Een belangrijk kenmerk van cohesiekrachten is dat ze snel afnemen wanneer de afstand toeneemt. Vervolgens worden ze cohesiekrachten genoemd naar de aantrekkingskrachten die optreden tussen de moleculen van dezelfde stof.
De Afstotende krachten Het zijn die die het gevolg zijn van kinetische energie (energie als gevolg van beweging) van deeltjes. Deze energie zorgt ervoor dat de moleculen constant in beweging zijn. De intensiteit van deze beweging is recht evenredig met de temperatuur waarbij de stof is.
Om de statusverandering van een stof te veroorzaken, is het noodzakelijk om de temperatuur te verhogen door middel van warmtetransmissie. Dit zorgt ervoor dat de afstotingskrachten van de stof toenemen, wat, indien van toepassing, uiteindelijk de wijziging van de staat kan aannemen.
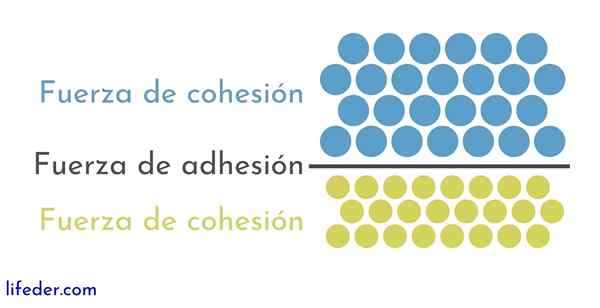
Aan de andere kant is het belangrijk en noodzakelijk om onderscheid te maken tussen samenhang en hechting:
- Cohesie is te wijten aan de aantrekkingskrachten tussen aangrenzende deeltjes van dezelfde stof.
- Hechting is het resultaat van de interactie die optreedt tussen oppervlakken van verschillende stoffen of lichamen.
Deze twee krachten lijken gerelateerd aan verschillende fysische fenomenen die vloeistoffen beïnvloeden, dus het is belangrijk een goed begrip van zowel de ene als de andere.
Het kan u van dienst zijn: Vy Canis Majoris: Discovery, Kenmerken, Structuur, Training en EvolutieCohesiekrachten in vaste stoffen, vloeistoffen en gassen
 Atomen in de drie belangrijkste toestanden van materie
Atomen in de drie belangrijkste toestanden van materie In vaste stoffen
Over het algemeen zijn cohesiekrachten in vaste stoffen zeer hoog en worden intens gegeven in de drie richtingen van de ruimte.
Op deze manier, als een externe kracht op een vast lichaam wordt uitgeoefend, vinden kleine verplaatsingen van de moleculen plaats met elkaar.
Wanneer de externe kracht verdwijnt, zijn de cohesiekrachten bovendien sterk genoeg om terug te keren naar de moleculen in hun oorspronkelijke positie, waardoor de positie wordt hersteld voorafgaand aan de toepassing van de kracht.
In vloeistoffen
Integendeel, in vloeistoffen zijn cohesiekrachten alleen hoog in twee van de ruimtelijke richtingen, terwijl ze erg zwak zijn tussen vloeistoflagen.
Dus wanneer een kracht in een tangentiële richting op een vloeistof wordt uitgeoefend, verbreekt deze kracht de zwakke bindingen tussen de lagen. Dit zorgt ervoor dat de vloeibare lagen over de andere glijden.
Wanneer de toepassing van de kracht wordt afgesloten, hebben de cohesiekrachten niet voldoende kracht om de vloeibare moleculen in zijn oorspronkelijke positie opnieuw te plaatsen.
Bovendien wordt in vloeistoffen de cohesie ook weerspiegeld in de oppervlaktespanning, veroorzaakt door een onevenwichtige kracht gericht op de binnenkant van de vloeistof, die op de oppervlaktemoleculen werkt.
Evenzo wordt cohesie ook waargenomen wanneer de overgang van de vloeibare toestand naar de vaste toestand wordt gegeven, vanwege het effect van compressie van vloeibare moleculen.
In gassen
In gassen zijn cohesiekrachten verachtelijk. Op deze manier zijn de gasemoleculen constant in beweging, omdat in hun geval de cohesiekrachten ze niet aan elkaar kunnen verbonden houden.
Kan u van dienst zijn: mechanisch voordeel: formule, vergelijkingen, berekening en voorbeeldenDaarom zijn de cohesiekrachten in de gassen alleen te zien wanneer het vloeibaarheidsproces plaatsvindt, dat plaatsvindt wanneer de gasvormige moleculen worden gecomprimeerd en de krachten van aantrekkingskracht sterk genoeg zijn om de overgang van de staatsgassa naar de vloeibare toestand te produceren.
Voorbeelden van cohesiekrachten
Vaak worden de cohesiekrachten gecombineerd met de adhesiekrachten om bepaalde fysische en chemische fenomenen te geven.
Cohesiekrachten kunnen bijvoorbeeld samen met die van hechting toestaan dat enkele van de meest voorkomende fenomenen die zich voordoen in vloeistoffen; Dit is het geval van meniscus, oppervlaktespanning en capillariteit.
Daarom is het in het geval van vloeistoffen noodzakelijk om onderscheid te maken tussen de cohesiekrachten, die optreden tussen de moleculen van dezelfde vloeistof; en die van hechting, die optreden tussen de moleculen van de vloeistof en de vaste stof.
Oppervlaktespanning

De oppervlaktespanning is de kracht die tangentieel en per lengte -eenheid op de rand van het vrije oppervlak van een vloeistof in evenwicht is. Deze kracht samentrekt het vloeibare oppervlak.
Uiteindelijk treedt oppervlaktespanning op omdat de krachten die zich voordoen in de vloeibare moleculen verschillend zijn op het oppervlak van de vloeistof dan die die zich voordoen binnen.
Meniscus
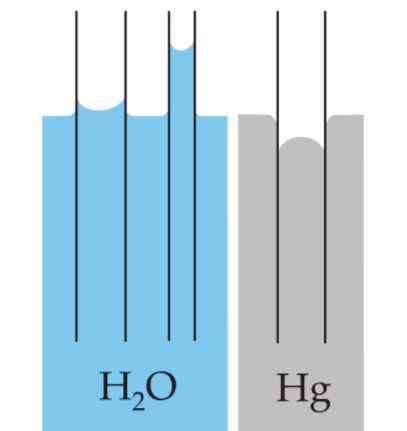
De kromming die op het oppervlak van de vloeistoffen wordt gecreëerd, wordt meniscus genoemd wanneer deze wordt beperkt in een container. Deze curve wordt geproduceerd door het effect dat het oppervlak van de container heeft op de vloeistof die het bevat.
Kan u van dienst zijn: drukmetersDe curve kan convex of concaaf zijn, afhankelijk van of de kracht tussen de moleculen van de vloeistof en die van de container van aantrekkingskracht is - zoals het geval is van water en glas - of van afstoting zijn, zoals het geval is tussen kwik en glas.
Capillariteit
 Voorbeeld van capillariteit
Voorbeeld van capillariteit Capillariteit is een eigenschap van vloeistoffen waarmee ze door een capillaire buis kunnen stijgen of afdalen. Het is de eigenschap die gedeeltelijk de opkomst van water in de planten mogelijk maakt.
Een vloeistof stijgt door de capillaire buis wanneer cohesiekrachten lager zijn dan die van de hechting tussen de vloeistof en de buiswanden. Op deze manier zal de vloeistof blijven stijgen totdat de waarde van de oppervlaktespanning gelijk is aan het gewicht van de vloeistof in de capillaire buis.
Integendeel, als de cohesiekrachten hoger zijn dan die van de hechting, zal de oppervlaktespanning afdalen naar de vloeistof en de vorm van het oppervlak zal convex zijn.
Referenties
- Cohesie (chemie) (n.D.)). In Wikipedia. Opgehaald van.Wikipedia.borg.
- Oppervlaktespanning (n.D.)). In Wikipedia. Opgehaald van.Wikipedia.borg.
- Capillariteit (n.D.)). In Wikipedia. Hersteld van ES.Wikipedia.borg.
- Iran. Levine; "Physicochemistry" Deel 1; Vijfde editie; 2004; Mc Graw Hillm.
- Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. (2005). Chemie: de moleculaire wetenschap. Belmont, CA: Brooks/Cole.
- Wit, Harvey en. (1948). Moderne universiteitsfysica. Van Nostrand.


