Moleculaire formule hoe het eruit te krijgen, voorbeelden en oefeningen
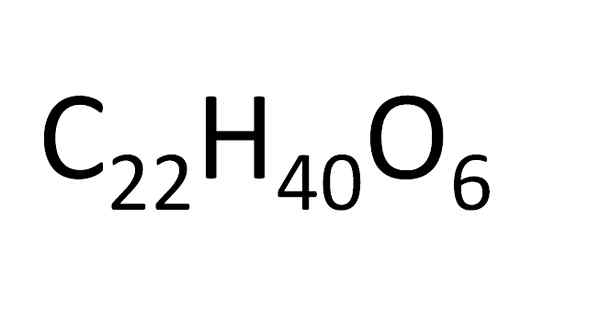
- 3745
- 1135
- Nathan Wiegand
De moleculaire formule Het is een weergave van een molecuul van een verbinding, waarin ze worden aangegeven, door zijn chemische symbolen, de atomen van alle elementen die in de verbinding aanwezig zijn en het aantal van hen. Elk atoom gaat vergezeld van een subscript.
De moleculaire formule heeft de beperking die niet de banden van de verschillende atomen van het molecuul of hun ruimtelijke relatie aangeven; zoals uitgedrukt door de structurele formule. In sommige gevallen is het bijvoorbeeld niet specifiek: C6H12OF6 Het is de moleculaire formule van glucose, galactose en fructose.
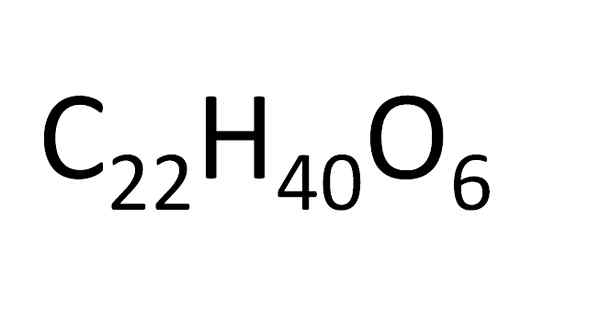 Uit dezelfde moleculaire formule kunnen eindeloze isomere verbindingen worden verkregen. Dit komt overeen met een organische samengestelde variabele hoge moleculaire massa. Bron: Gabriel Bolívar.
Uit dezelfde moleculaire formule kunnen eindeloze isomere verbindingen worden verkregen. Dit komt overeen met een organische samengestelde variabele hoge moleculaire massa. Bron: Gabriel Bolívar. Er zijn een reeks regels voor de verwijdering van atomen in een moleculaire formule. Voor ionische zouten, bijvoorbeeld natriumchloride, wordt het kationsymbool eerst geplaatst (NA+) en dan het anionsymbool (CL-)). Dit is de reden waarom de moleculaire formule van natriumchloride NaCl is.
De moleculaire formule van organische verbindingen wordt geschreven door eerst het koolstofsymbool (C) te plaatsen, gevolgd door het waterstofsymbool (H) en vervolgens de resterende atomen. De moleculaire formule van azijnzuur is bijvoorbeeld C2H4OF2.
[TOC]
Hoe u de moleculaire formule kunt krijgen
Het verkrijgen van de moleculaire formule van een verbinding is gebaseerd op de vorige instelling van de minimale of empirische formule daarvan. Om deze reden zijn de eerste stappen bij het verkrijgen van beide formules gebruikelijk.
Eerste stap
De uitdrukking van de massa van de elementen van een chemische verbinding in een procentuele vorm is gebruikelijk. Een eenvoudige berekening moet vervolgens worden uitgevoerd om de massapercentages van de verschillende elementen te transformeren in hun massa uitgedrukt in gram.
Kan u van dienst zijn: percentageconcentratieTweede stap
Als je de massa in gram van elk van de elementen kent, en de atoommassa ervan, kun je het relatieve aantal van elk atoom verkrijgen of het aantal mol mol.
Derde stap
Het relatieve aantal van alle atomen, tussen het relatieve aantal lagere waarde. De minimale verhoudingswaarden moeten een geheel getal zijn. In het geval dat een waarde van het aandeel een decimaal bevat, moet een correctie worden gemaakt die een dergelijk decimaal laat verdwijnen.
De correctie bestaat uit het vermenigvuldigen van alle waarden van het aandeel met een nummer dat terugkeert naar alle waarden. Als een minimale verhoudingswaarde bijvoorbeeld 1 is.25, alle waarden moeten worden vermenigvuldigd met vier (4). Sinds 1.25 vermenigvuldigd met 4 is gelijk aan 5, een geheel getal.
Vierde stap
Alle chemische symbolen van de elementen van de verbinding worden geplaatst en met hun overeenkomstige subscript; dat wil zeggen de waarde van het minimale aandeel van het element.
Vijfde stap
De minimale formule van een verbinding kan worden omgezet in zijn moleculaire formule door de relatie te verkrijgen tussen het molecuulgewicht van de verbinding en het gewicht van de minimale formule (N). Deze relatie is hetzelfde dat bestaat tussen de moleculaire formule en de minimale formule.
n = molecuulgewicht van de verbinding / gewicht van de minimale formule
Om de moleculaire formule te verkrijgen, moet de minimale formule worden vermenigvuldigd met n. Dit houdt in dat elk van de subscripts van de minimale formule moet worden vermenigvuldigd met n.
n = molecuulgewicht / minimale formulegewicht
= Moleculaire formule / minimale formule
Kan u van dienst zijn: zuurstof: eigenschappen, structuur, risico's, gebruikMoleculaire formule = N · Minimale formule
Voorbeelden van moleculaire formules
Hieronder staan enkele veel voorkomende moleculaire formules:
-Ferro -oxide (lelijk)
-Natriumhydroxide (NaOH)
-Kaliumoxide (k2OF)
-Perchlooroxide (Cl2OF7))
-Ferric Hydroxide [Faith (OH)3]
-Calciumchloride (CACL2))
-Zoutzuur (HCL)
-Natriumsulfaat (n2SW4))
-Zwavelzuur (h2SW4))
-Perbrominezuur (hbro4))
-Aluminiumchloride (alcl3))
-Methaan (ch4))
-Propaan (c3H8))
-Etano (c2H6))
-Ethylalcohol (c2H6OF)
-Azijnzuur (c2H4OF2))
-Benzeen (c6H6))
-Glucose (c6H12OF6))
Opgeloste oefeningen
- Oefening 1
Metyl Benzoate heeft de volgende massapercentages:
C: 70,57 %,
H: 5,93 %
O: 23,49 %
En een molecuulgewicht van 136,1 g/mol. Bepaal de moleculaire formule.
Eerste stap
De eerste stap is om de massapercentages van de elementen in hun massa in gram uit te drukken, wetende dat massaspercentages in relatie tot het molecuulgewicht zijn.
Van de 136,1 gram die overeenkomt met de mol van de verbinding, vertegenwoordigt 70,57% alleen koolstof. En zo verder met de resterende elementen:
Koolmassa = 136,1 g · (70.57/100)
= 96,05 g
Waterstofmassa = 136,1 g · (5.93/100)
= 8,06 g
Zuurstofmassa = 136.1 · (23.49/100)
= 31,96 g
Tweede stap
Bij de uitwerking van de moleculaire formule moeten de relatieve aantallen van de atomen (NRA) worden bepaald. Om dit te doen, zijn de massa's van de elementen verdeeld tussen hun atoommassa:
NRA (C) = 96 g / 12 g
= 8
Nra (h) = 8 g / 1 g
= 8 g
NRA (O) = 32 g / 16 g
= 2
Derde stap
We moeten dan de minimale verhoudingen van de elementen (PME) berekenen. Hiervoor zijn alle NRA -waarden verdeeld tussen de waarde van kleine NRA:
PME (C) = 8/2
= 4
PME (H) = 8/2
= 4
PME (O) = 2/2
= 1
Vierde stap
Schrijf de minimale formule van methylbenzoaat, gebaseerd op het feit dat de subscripts van de elementen hun minimale verhoudingen zijn berekend:
Kan u dienen: natriumdichromaat (Na2CR2O7): eigenschappen, productie, gebruikC4H4OF
Vijfde stap
Ten slotte moet de moleculaire formule van methylbenzoaat worden vastgesteld. We berekenen dan:
n = molecuulgewicht / minimale formulegewicht
Het minimale formulegewicht wordt 68 g/mol:
= 136.1 g / 68 g
n ≈ 2
Moleculaire formule = 2 · Minimale formule
= 2 · c4H4OF
Moleculaire formule van methylbenzoaat = C8H8OF2
- Oefening 2
De percentages van de elementen die benzeen vormen, zijn de volgende:
C: 92,36 %
H: 7,64 %.
Het molecuulgewicht van benzeen is 78 g/mol. Bepaal de moleculaire formule.
Eerste stap
Transformeer de massapercentages van de elementen in hun massa in gram:
Koolmassa = 78 g · (92.36/100)
= 72.04 g
Waterstofmassa = 78 g · (7.64/100)
= 5,96 g
Tweede stap
Berekening van de relatieve getallen van de atomen (NRA). Om dit te doen, zijn de massa's van de elementen verdeeld tussen hun atoommassa:
NRA (C) = 72 g / 12 g
= 6
Nra (h) = 6 g / 1 g
= 6
Derde stap
Berekening van de waarden van het minimale deel van de elementen (PME). Dit wordt berekend door de NRA -waarden van alle elementen tussen de lagere waarde van NRA te delen:
PME (C) = 6/6
= 1
PME (H) = 6/6
= 1
Vierde stap
Akte van de minimale benzeenformule, rekening houdend met dat de subscripts van de elementen de waarden zijn van de minimale berekende proportie.
Minimale benzeenformule: Ch
Vijfde stap
De oprichting van de moleculaire formule door de relatie tussen de moleculaire massa en de massa van de minimale formule te berekenen:
n = molecuulgewicht / minimale formulegewicht
= 78 g / 13 g
n = 6
Moleculaire formule = N · Minimale formule
= 6 · Ch
= C6H6
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Wikipedia. (2020). Chemische formule. Opgehaald uit: in.Wikipedia.borg
- Boundless Learning. (S.F.)). Moleculaire formules. Hersteld van: cursussen.Lumenarning.com
- Helmestine, Anne Marie, pH.D. (29 september 2019). Empirische en moleculaire berekeningsformules. Hersteld van: Thoughtco.com
- Peter J. Mikulecky, Chris Hren. (2020). Hoe empirische formules te gebruiken om moleculaire formules te vinden. Hersteld van: dummies.com
- « Minimale formule hoe de minimale formule, voorbeelden en oefeningen te verwijderen
- Globaliseringsgeschiedenis, kenmerken, oorzaken, gevolgen »

