Kaliumfosfaat (K3PO4) structuur, eigenschappen, gebruik

- 2198
- 45
- Glen Armstrong
Hij Kaliumfosfaat Het is een anorganische verbinding gevormd door drie ionen kalium k+ en een fosfaat -ion po43-. De chemische formule is k3Po4. Het is een kleurloze vaste of kristallijn wit. Het is erg oplosbaar in water, die alkalische oplossingen vormt, dat wil zeggen met veel oh ionen-, Daarom fundamentele pH.
Het fosfaation heeft een belangrijke functie in cellen die te maken heeft met energieopslag. Kaliumfosfaat wordt veel gebruikt in organische chemische reacties waarin het als basis kan fungeren, dat wil zeggen protonen h+. Het kan ook functioneren als een katalysator of versneller van sommige reacties.
 Kaliumfosfaat K3Po4 stevig. Xavier13540 bij Chinese Wikipedia [Public Domain]. Bron: Wikimedia Commons.
Kaliumfosfaat K3Po4 stevig. Xavier13540 bij Chinese Wikipedia [Public Domain]. Bron: Wikimedia Commons. Het is gebruikt om de aanval van bepaalde insecten in tarweplanten te verminderen, omdat het hen hiervoor beter bestand is. Er is echter waargenomen dat het de detachement van methaan bevordert (CH4), Een broeikasgas, rijstmicroculturen.
Het is gebruikt als een laxeermiddel, om de duur van een lokale anesthesie te verhogen, om cariës te stoppen en om oppervlakken te helpen onder andere toepassingen.
[TOC]
Structuur
Kaliumfosfaat bestaat uit drie kationen kalium k+ en een fosfaatanion po43-.
De fosfaat -ionen PO43- Het wordt gevormd door een fosfor (p) atoom en vier zuurstof (O) atomen, waarbij fosfor een oxidatietoestand van +5 en zuurstof heeft een valentie van -2-2.
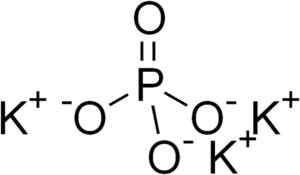 Kaliumfosfaatstructuur k3Po4. Edgar181 [Public Domain]. Bron: Wikimedia Commons.
Kaliumfosfaatstructuur k3Po4. Edgar181 [Public Domain]. Bron: Wikimedia Commons. Nomenclatuur
- Kaliumfosfaat
- Tripotasiumfosfaat
- Kaliumtribasische fosfaat
- Tripotasium orthofosfaat
Eigenschappen
Fysieke staat
Kleurloze vaste of kristallijn wit.
Molecuulgewicht
212.27 g/mol
Smeltpunt
1340 ºC
Dikte
2,564 g/cm3
Oplosbaarheid
Zeer oplosbaar in water: 106 g/100 g water bij 25 ° C. Onoplosbaar in ethanol.
pH
Een oplossing met 1% k3Po4 Het heeft een pH van 11,5-12,3.
Chemische eigenschappen
Door op te lossen in water, wordt kaliumfosfaat gescheiden in de drie kationen kalium k+ en de fosfaatanion PO43-. Het fosfaatanion neemt een proton van water en het HPO -hydrogenofosfaatanion wordt gevormd42-. De laatste neemt op zijn beurt nog een proton van water en wordt het dihydrogenofosfaat H -anion2Po4-.
Kan u van dienst zijn: hoe wordt een elastisch materiaal gesynthetiseerd?Po43- + H2Of ⇔ HPO42- + Oh-
HPO42- + H2Of ⇔ h2Po4- + Oh-
Wanneer vorm ionen oh- De waterige oplossing wordt alkalisch.
Andere eigenschappen
Naast de watervrijvorm (zonder water) heeft het verschillende gehydrateerde vormen; Dit betekent dat het k -molecuul3Po4 Het kan worden gepaard met een of meer watermoleculen in de kristallijne structuur.
Om deze reden kunt u bijvoorbeeld K monohydraat vormen3Po4.H2Of3Po4.3H2Of, hepthydraat en niet -dehydraat.
Fosfaatfunctie in het menselijk organisme
De fosfaat -ionen PO43- Het is het meest voorkomende anion in de cellen en oefent een belangrijke functie uit in energieopslag.
Het fosfaationen neemt ook deel aan vorming- en voedingsactiviteiten van botten en tanden, omdat het de concentratie van calciumconcentratie op bloedserum en in talloze energieoverdrachtsreacties in de cel reguleert.
Het verkrijgen van
Kaliumfosfaat kan worden verkregen uit de reactie tussen KCL -kaliumchloride en ammoniumfosfaat (NH4))3Po4.
Kaliumchloride + ammoniumfosfaat → kaliumfosfaat + ammoniumchloride
3 KCl + (NH4))3Po4 → K3Po4 + 3 NH4Klet
Toepassingen
Als basis in organische chemische reacties
Kaliumfosfaat K3Po4 Het is gebruikt in verschillende organische chemische reacties. Het dient bijvoorbeeld in de synthese van acetylenen op basis van dibromed verbindingen.
In deze synthese treedt een dehydrobromatie (eliminatie van waterstof en bromo) op, waar de k3Po4 Ashidro vaste (zonder water) werkt als een zachte basis en neemt twee protonen uit het molecuul, de twee broomatomen worden geëlimineerd en het overeenkomstige acetyleen wordt verkregen.
C6H5-Chbr-CH2Br + 2 K3Po4 → c6H5-C≡CH + 2 KBR + 2 K2HPO4
 Auteur: Clker-vrije-vector-afbeeldingen. Bron: Pixabay.
Auteur: Clker-vrije-vector-afbeeldingen. Bron: Pixabay. Als katalysator
De K3Po4 Het dient als een katalysator in verschillende organische chemische reacties. Het is bijvoorbeeld gebruikt als een vaste stof voor het verkrijgen van biodiesel uit gebruikte koekenolie.
Biodiesel is een brandstof vergelijkbaar met diesel maar verkregen uit vetten of natuurlijke oliën die zijn gebruikt of niet.
Kan u van dienst zijn: coulombimetrie: fundamentals, typen, toepassingenKaliumfosfaat was effectiever als een katalysator of versneller van genoemde reactie dan natriumfosfaat3Po4 en Cao calciumoxide.
In de landbouw
De K3Po4 Het is gebruikt om tarweplanten te behandelen en ze bestand te maken tegen bepaalde ongedierte.
 Tarwplanten kunnen worden behandeld met K3Po4 om bestand te zijn tegen sommige soorten insecten. Auteur: Hans Braxmeier. Bron: Pixabay.
Tarwplanten kunnen worden behandeld met K3Po4 om bestand te zijn tegen sommige soorten insecten. Auteur: Hans Braxmeier. Bron: Pixabay. Sommige onderzoekers probeerden tarwezaailingen met kaliumfosfaat en bleken dat deze weerstand tegen bladluis Duraphis Noxia, Een insect dat deze planten aanvalt.
Na het aanbrengen van een verdunde oplossing van K3Po4 Op de zaailingen was er minder ernst van de symptomen veroorzaakt door deze insecten en een verminderd aantal bladluizen die zich hierop voeden.
 Auteur: Hans Braxmeier. Bron: Pixabay.
Auteur: Hans Braxmeier. Bron: Pixabay. In medische toepassingen
Kaliumfosfaat is gebruikt om het anesthetische effect van lidocaïne te wijzigen, een lokale verdoving. Een lokale verdoving is een medicijn dat wanneer toegepast in een gebied van het lichaam verlies van pijngevoeligheid in dat gebied produceert.
Het bleek dat k3Po4 Het maakt het mogelijk om de lokale anesthesie van lidocaïne te verlengen.
Zoals laxeermiddel
Kaliumfosfaat verhoogt de vloeibaarheid van het darmgehalte omdat het helpt water te behouden in de darm, wat indirect de samentrekking van de darmspier induceert.
In veterinaire geneeskunde
De K3Po4 Het wordt gebruikt bij dieren met diabetische ketoacidose (een complicatie van diabetes) om hypofospathie te behandelen (kleine hoeveelheid fosfaat in het bloed).
Wanneer het echter overtollig wordt geleverd, kan het hypocalciëmie (weinig calcium in het bloed), hyperfospathie (overtollig fosfaat in het bloed) veroorzaken, onvrijwillige samentrekking van de spieren, mineralisatie van zachte weefsels en nierfalen.
 Honden met diabetische acidose kunnen worden behandeld met kaliumfosfaat. Auteur: David Mark. Bron: Pixabay.
Honden met diabetische acidose kunnen worden behandeld met kaliumfosfaat. Auteur: David Mark. Bron: Pixabay. Bij het verkrijgen van DNA
Kaliumfosfaat is gebruikt als een buffer om DNA te zuiveren in genetica -laboratoria.
DNA is een eiwit dat in cellen wordt gevonden en bevat alle genetische informatie die nodig is voor de ontwikkeling en functioneren van levende wezens.
Het kan u van dienst zijn: fractionele destillatie: proces, apparatuur, toepassingen, voorbeeldenDoor DNA te isoleren, duiken wetenschappers in de studie van hoe erfelijke karakters worden overgedragen, dus kaliumfosfaat is zeer nuttig.
 DNA -molecuul tekenen. Auteur: Public DomainPartures. Bron: Pixabay.
DNA -molecuul tekenen. Auteur: Public DomainPartures. Bron: Pixabay. In verschillende toepassingen
Kaliumfosfaat K3Po4 het dient:
- als een dieet supplement,
- voor elektrolytvervanging,
- Als buffer, dat wil zeggen als een chemisch systeem dat mogelijk OH -ionenniveaus kan beheersen- of waterstof h+ In waterige oplossing,
- Om de vorming van cariës te stoppen of te remmen,
- als corrosieremmer en anti -SNIFF -agent,
- als een agent om oppervlakken en coatingmiddel te behandelen,
- Als antivries,
- bij het schoonmaken van producten.
 Gecorrodeerde buizen. De K3Po4 maakt het mogelijk corrosie te voorkomen in de leidingen van sommige industrieën of processen. Auteur: Michael Gaida. Bron: Pixabay.
Gecorrodeerde buizen. De K3Po4 maakt het mogelijk corrosie te voorkomen in de leidingen van sommige industrieën of processen. Auteur: Michael Gaida. Bron: Pixabay. Negatief aspect voor gebruik in de landbouw
Bepaalde onderzoekers ontdekten dat door K toe te voegen3Po4 Een methaanemissie wordt verhoogd tot een rijstmicrocultuur (kies4) naar de sfeer. Methaan is een gas dat bijdraagt aan het broeikaseffect en de toename van de temperatuur van onze planeet.
Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Kaliumfosfaat. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Panciera, D.L. (2012). Vloeistoftherapie bij endocriene en metabole stoornissen. Fosfor -suppletie. Bij vloeistof-, elektrolyt- en zuur-base-aandoeningen in de praktijk van de kleine dieren (vierde editie). Hersteld van Scientedirect.com.
- Shenawi-Khalil, s. et al. (2012). Synthese van acetyleenen via dehydrobromatie met behulp van vast watervrij kaliumfosfaat als de basis onder fasestoorconditie. Tetrahedron Letters, Deel 53, nummer 18, 2012, pagina's 2295-2297. Hersteld van Scientedirect.com.
- Guan, g. et al. (2009). Tri-Passium-fosfaat als een vaste katalysator voor biodieselproductie van afvalkookolie. Brandstofverwerkingstechnologie, Volume 90, nummer 4, 2009, pagina's 520-524. Hersteld van Scientedirect.com.
- Kulkami, m.NAAR. (2012). Mechanistische benadering voor expansie en oplosmiddelvrije synthese van a-hydroxyfosfonaten met behulp van kaliumfosfaat als katalysator. Comptes Rendus Chimie, Vol 16, nummer 2, 2013, pagina's 148-152. Hersteld van Scientedirect.com.
- Venter, E. et al. (2014). Kaliumfhosfaat induceert tolerantie anti -instal de Russische tarwe bladluis (Duraphis Noxia, Homoptera: Aphididae) in tarwe. Crop Protection Vol 61, juli 2014, pagina's 43-50. Hersteld van Scientedirect.com.
- Bonturi, n. et al. (2013). Natriumcitraat en kaliumfosfaat als alternatieve adsorptiebuffers in hydrofobe en aromatische thiofiele chromatografische zuivering van plasmide -DNA uit geneutraliseerd lysaat. Journal of Chromatography B, Volumes 919-920, 2013, pagina's 67-74. Hersteld van Scientedirect.com.
- Conrad, r. en Klose, m. (2005). Effect van kaliumfosfaatbemesting op de productie en emissie van methaan en zijn 13C-stabiele isotoopsamenstelling in rijstmicrokosmos. Soil Biology and Biochemistry, Vol 37, uitgave 11, 2005, pagina's 2099-2108. Hersteld van Scientedirect.com.
- Lead, D.R. (redacteur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- Rookvoet. (2019). Tipotassiumfosfaat. Opgehaald van.Wikipedia.borg
- « Kenmerken invoerapparaten, wat zijn het gebruik, typen, voorbeelden
- Tumornecrosefactor (TNF) structuur, werkingsmechanisme, functie »

