Tumornecrosefactor (TNF) structuur, werkingsmechanisme, functie
- 3488
- 80
- Lonnie Rohan
Hij Tumornecrosefactor (TNF), ook bekend als caquectine, is een natuurlijk geproduceerd eiwit in fagocytaire of macrofaagcellen van het menselijk lichaam en andere zoogdieren. Het is een zeer belangrijke cytoquine die deelneemt aan zowel normale fysiologische processen als in diversiteit van lichaamspathologische processen.
Zijn ontdekking dateert van iets meer dan 100 jaar geleden, toen W. Coley gebruikte rauwe bacteriële extracten om tumoren bij verschillende patiënten te behandelen en ontdekte dat deze extracten het vermogen hadden om de necrose van deze tumoren te induceren, terwijl een systemische ontstekingsreactie bij patiënten bij patiënten werd geactiveerd bij patiënten.
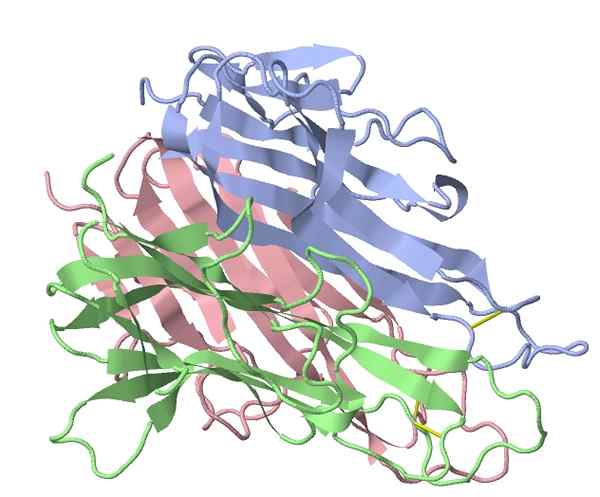
 Tumornecrose alfa muisfactor (Bron: TK Vallery/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/3.0) Via Wikimedia Commons)
Tumornecrose alfa muisfactor (Bron: TK Vallery/CC BY-SA (https: // creativeCommons.Org/licenties/by-sa/3.0) Via Wikimedia Commons) De belangrijkste "pro-inflammatoire" stimulator geactiveerd door de bacteriële extracten die door Coley werden gebruikt, werd geïdentificeerd in 1975, waaruit bleek dat een eiwitfactor in het serum van behandelde patiënten tumorlysis veroorzaakte, waarbij de naam die deze groep van deze groep identificeert, eiwitten ontstonden (TNF -a).
Ongeveer 10 jaar later, in 1984, werd het "tumornecrosefactor" -gen geïsoleerd en gekarakteriseerd, en op dezelfde datum werd een ander soortgelijk eiwit geïsoleerd en gezuiverd in de T -lymfocyten, die "T alpha t lymfotoxine" (TLa) werd genoemd, (TLa), die vervolgens bekend stond als een TNF-β-factor.
Momenteel zijn talrijke eiwitten die vergelijkbaar zijn met de oorspronkelijk beschreven TNF gedefinieerd, die de TNF-eiwitfamilie (tumornecrosefactor type) vormen en inclusief TNF-a, TNF-β-eiwitten, de CD40 ligand (CD40L), de ligand FAS ( Fasl) en vele anderen.
[TOC]
Structuur
Op genniveau
Het coderingsgen voor het TNF-α-eiwit wordt gevonden in chromosoom 6 (chromosoom 17 bij knaagdieren) en degene die codeert voor het TNF-β-eiwit voorafgaat aan de vorige in beide gevallen (menselijke en knaagdieren). Deze twee genen zijn in één kopie en hebben een geschatte grootte van 3 kb.
Gezien het feit dat de sequentie die overeenkomt met het promoterende gebied van het TNF-α-gen verschillende vakbondslocaties heeft voor een transcriptiefactor die bekend staat als de "kappa B-nucleaire factor" (NF-KB), zijn veel auteurs van mening dat hun expressie afhankelijk is van hun expressie Deze factor.
Het promotorgebied van het TNF-β-gen, daarentegen, heeft een volgorde van unie voor een ander eiwit dat bekend staat als "High Mobility Group 1" (HMG-1, van het Engels High Mobility Group 1).
Kan u van dienst zijn: myosine: kenmerken, structuur, typen en functieOp eiwitniveau
Twee vormen van de Alfa-tumornecrosefactor zijn beschreven, een die is gekoppeld aan het membraan (MTNF-a) en een andere die altijd oplosbaar is (STNF-a). Beta-tumornecrosefactor bestaat daarentegen alleen in een oplosbare vorm (STNF-β).
Bij mensen bestaat de TNF-a-membranale vorm uit een polypeptide van iets meer dan 150 aminozuurafval, die zijn bevestigd aan een "leider" -sequentie van 76 extra aminozuren. Het heeft een duidelijk molecuulgewicht van ongeveer 26 kDa.
De translocatie van dit eiwit naar het membraan vindt plaats tijdens de synthese en deze vorm wordt "omgezet" in de oplosbare vorm (17 kDa) door een enzym dat bekend staat als "het converterende enzym van TNF-a", in staat om Mtnf-a in stnf te transformeren in stnf -a.
Werkingsmechanisme
Eiwitten die behoren tot de tumornecrosefactorgroep (TNF) oefenen hun functies voornamelijk uit dankzij hun associatie met specifieke receptoren in menselijke lichaamscellen en andere dieren.
Er zijn twee soorten receptoren voor TNF-eiwitten in plasmamembranen van veel lichaamscellen, met uitzondering van erytrocyten: type I-receptoren (TNFR-55) en type II-receptoren (TNFR-75).
Beide soorten receptoren delen een structurele homologie met betrekking tot de extracellulaire vakbondsplaats voor TNF -eiwitten en binden hier ook aan met equivalente affiniteit. Ze verschillen dan in de intracellulaire signaalroutes die worden geactiveerd zodra het proces van binding van ligand-ontvanger is opgetreden.
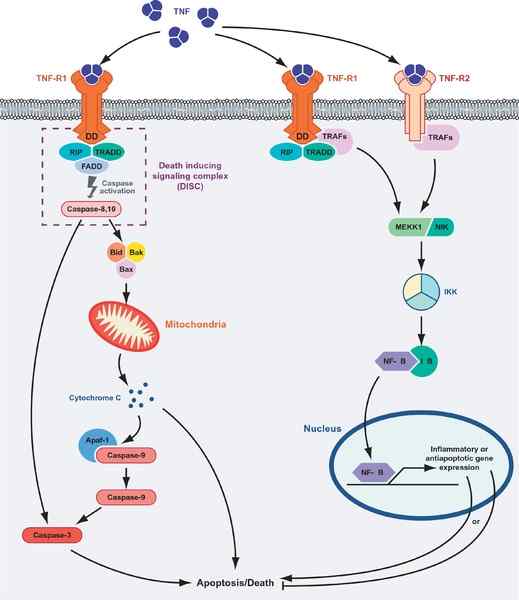 Celdood of overleving gemedieerd door TNF -eiwitten. Links van de afbeelding wordt de apoptotische route getoond en de "overlevings" -route (bron: masmudur m. Rahman, Grant McFadden/CC door (https: // creativeCommons.Org/licenties/door/1.0) Via Wikimedia Commons)
Celdood of overleving gemedieerd door TNF -eiwitten. Links van de afbeelding wordt de apoptotische route getoond en de "overlevings" -route (bron: masmudur m. Rahman, Grant McFadden/CC door (https: // creativeCommons.Org/licenties/door/1.0) Via Wikimedia Commons) De ligand-receptorinteractie van de TNF met een van zijn receptoren bevordert de vereniging van drie receptoren naar een oplosbaar trimeer van de TNF-a (trimerisatie van de receptoren), en deze interactie veroorzaakt cellulaire responsen, zelfs wanneer slechts 10% van de receptoren zijn bezet.
Unie in type I -receptoren
De ligand-receptorunie met type I-receptoren dient als een "wervingsplatform" van andere signaaleiwitten in de cytosolische domeinen van de receptoren (het interne gedeelte). Onder deze eiwitten is de eerste die "krijgen" het Tradd- of eiwiteiwit met dodendomein geassocieerd met de TNFR-1-receptor (Engels TNFR-1-geassocieerd Death Domain-eiwit)).
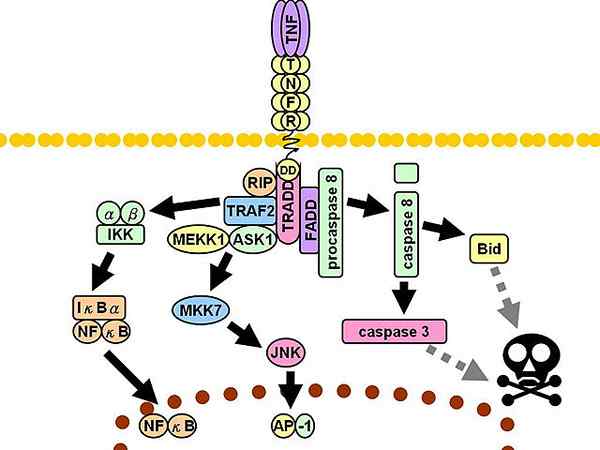 TNFR1 -signaalroute. Discontinue grijze lijnen vertegenwoordigen meerdere stappen.
TNFR1 -signaalroute. Discontinue grijze lijnen vertegenwoordigen meerdere stappen. Vervolgens worden drie extra bemiddelaars aangeworven: interactie -eiwit met ontvanger 1 (RIP1, uit het Engels Ontvanger-interne eiwit 1), Eiwit met overlijdens domein geassocieerd met FAS (FADD, Engels FAS-geassocieerd Death Domain-eiwit) en factor 2 geassocieerd met de TNF -ontvanger (TRAF2, Engels TNF-receptor-geassocieerde factor 2)).
Kan u dienen: fenylalanine: kenmerken, functies, biosynthese, voedselType II -receptoren
Wanneer de TNF bindt aan type II -receptoren, resulteert dit in de directe werving van het TRAF2 -eiwit, dat op zijn beurt het TRAF1 -eiwit werft. Deze eiwitten activeren de MAPK -eiwitroutes (uit het Engels Mythogeen-geactiveerd eiwitkinase), zeer belangrijk vanuit het oogpunt van intracellulaire signaal in eukaryoten.
Veel van de signaalroutes die worden geactiveerd na de vereniging van TNF -factoren voor hun receptoren, zijn ook gerelateerd aan de activering van specifieke transcriptiefactoren, die gemeenschappelijke reacties veroorzaken die zijn beschreven als biologische "effecten" van TNF -eiwitten.
Functie
TNF-α-eiwit wordt voornamelijk geproduceerd door macrofagen van het immuunsysteem, terwijl TNF-β-eiwit wordt geproduceerd door T-lymfocyten. Er is echter aangetoond dat andere lichaamscellen deze factoren ook produceren, hoewel in mindere mate.
De tumornecrosefactor is zeer bestudeerd vanwege de implicaties ervan in normale fysiologische processen, evenals in acute en chronische inflammatoire pathologische processen, bij auto -immuunziekten en bij inflammatoire processen gerelateerd aan verschillende soorten kanker.
Deze eiwitten zijn gekoppeld aan snel gewichtsverlies bij patiënten die lijden aan acute bacteriële infecties, die aan kanker lijden en die een septische "botsing" passeren.
Drie verschillende biologische activiteiten zijn beschreven voor tumornecrosefactor:
- Cytotoxiciteit tegen tumorcellen
- Onderdrukking van lipoproteïne lipase van adipocyten (LPL) en
- Vermindering van het rustpotentieel van het myocytenmembraan (spiercellen).
De TNF-a-membranale vorm bevordert cytotoxiciteit en is betrokken geweest bij de paracriene activiteiten van de TNF in bepaalde weefsels.
Wanneer een stimulus als bacteriële endotoxine wordt waargenomen, is deze vorm proteolypro actieve TNF in serum en andere lichaamsvloeistoffen.
Kan u van dienst zijn: enzym: bediening en voorbeeldenVan de biologische functies kunnen TNF -eiwitten ook bijdragen aan activering en migratie van lymfocyten en leukocyten, en celproliferatie, differentiatie en apoptose bevorderen.
Remmers
Veel behandelen artsen recept TNF-eiwitremmers voor patiënten met auto-immuunziekten (anti-TNF-therapie). Onder deze stoffen zijn: infliximab, etanercept, adalimumab, golimumab en certolizumab pegol.
De meest voorkomende vorm van gebruik is door subcutane injecties in de dijen of buik, en zelfs directe veneuze infusie wordt beoefend. Ondanks hoeveel van deze stoffen bepaalde patiënten kunnen helpen, zijn er enkele nadelige effecten die verband houden met het gebruik ervan, waaronder een toename van het risico op contacten zoals tuberculose of andere schimmelinfecties.
"Natuurlijke" niet -farmacologische remmers
Sommige "gesneden" fragmenten van de TNF (Type I en Type II) -eiwitten zijn ook bekend als TNF Union-eiwitten (TNF-BPS, Engels Bindende eiwitten factor necrose tumor) zijn gedetecteerd in de urine van patiënten met kanker, aids of sepsis.
In sommige gevallen remmen of neutraliseren deze fragmenten de activiteit van TNF-eiwitten, omdat ze ligand-receptor-interactie vermijden.
Andere "natuurlijke" remmers van TNF -eiwitten zijn gedetecteerd in sommige plantproducten die zijn afgeleid van kurkuma en granaat, hoewel er in dit opzicht nog steeds studies worden uitgevoerd.
Referenties
- Baud, v., & Karin, m. (2001). Signaaltransductie door tumornecrosefactor en zijn familieleden. Trends in celbiologie, 11 (9), 372-377.
- Chu, W. M. (2013). Factor necrosis tumor. Cancer Lotters, 328 (2), 222-225.
- Kalliolias, g. D., & Ivkiv, l. B. (2016). TNF -biologie, pathogene mechanismen en opkomende therapeutische strategieën. Nature Reviews Rheumatology, 12 (1), 49.
- Lis, k., Kuzawińska, of., & Bałkowiec -kra, en. (2014). Necrose-tumorremmers-state factor van kennis. Archives of Medical Science: AMS, 10 (6), 1175.
- Tracey, MD, K. J., & Cerami, pH. Geeft. (1994). Necrosis tumorfactor: een pleiototrope cytokine en therapeutisch doelwit. Jaaroverzicht van de geneeskunde, 45 (1), 491-503.
- Wu, h., & Hymowitz, s. G. (2010). Structuur en functie van tumornecrosefactor (TNF) aan het celoppervlak. In Handbook of Cell Signaling (PP. 265-275). Academische pers.
- « Kaliumfosfaat (K3PO4) structuur, eigenschappen, gebruik
- Wat is de theorie van geschiedenis of historiologie? »

