Magnesiumfosfaat (Mg3 (PO4) 2)
- 920
- 181
- Glen Armstrong
 Structuur en formule van magnesiumfosfaat
Structuur en formule van magnesiumfosfaat Wat is magnesiumfosfaat?
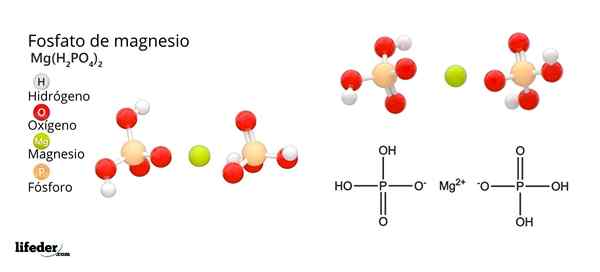
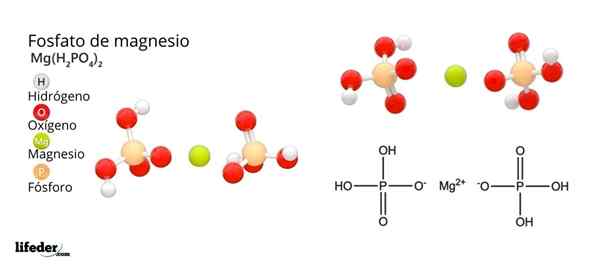
Hij Magnesiumfosfaat Het is een term die wordt gebruikt om te verwijzen naar een familie van anorganische verbindingen gevormd door magnesium, alkalisch metaal en fosfaatoxoanion. Het eenvoudigste magnesiumfosfaat heeft een Mg chemische formule3(PO4))2. De formule geeft aan dat voor elke twee anionen PO43- Er zijn drie mg kationen2+ Interactie hiermee.
Ook kunnen deze verbindingen worden omschreven als magnesiumzouten afgeleid van orthofosfahinezuur (h3Po4)). Met andere woorden, magnesium wordt "verzameld" tussen fosfaatanionen, ongeacht de anorganische of organische presentatie (mgo, mg (nee3))2, Mgcl2, Mg (oh)2, enz.)).
Vanwege deze redenen zijn magnesiumfosfaten te vinden als verschillende mineralen. Sommige hiervan zijn: catteite -mg3(PO4))2 · 22H2O-, Struvita -(NH4) MGPO4· 6h2Of wiens microkristallen worden weergegeven in de superieure afbeelding, Holtedalita -Mg2(PO4) (Oh) - en bobierrite -mg3(PO4))2· 8h2OF-.
In het geval van het bobierriet is de kristallijne structuur monoklinisch, met kristallijne aggregaten met massieve fans en rozetten. Magnesiumfosfaten worden echter gekenmerkt door een rijke structurele chemische stof te vertonen, wat betekent dat hun ionen veel kristallijne arrangementen aannemen.
Magnesiumfosfaatvormen en de neutraliteit van hun belastingen
Magnesiumfosfaten zijn afgeleid van de vervanging van H -protonen3Po4. Wanneer orthofosforzuur een proton verliest, blijft het als het fosfaatdihydrogen -ion2Po4-.
Hoe de negatieve belasting te neutraliseren om een magnesiumzout te veroorzaken? Ja mg2+ Goed voor twee positieve kosten, heeft dan twee H nodig2Po4-. Aldus wordt magnesium diácido fosfaat verkregen, mg (h2Po4))2.
Dan, wanneer het zuur twee protonen verliest, blijft het hydrogenfosfaation over, HPO42-. Nu hoe deze twee negatieve ladingen te neutraliseren? Zoals de MG2+ U hebt slechts twee negatieve ladingen nodig om te neutraliseren, interageren met een enkel HPO -ion42-. Op deze manier wordt magnesiumzuurfosfaat verkregen: MGHPO4.
Kan u van dienst zijn: magnesiumoxide: structuur, eigenschappen, nomenclatuur, gebruikTen slotte, wanneer alle protonen verloren gaan, blijft de fosfaatanion bestaan43-. Dit vereist drie mg kationen2+ en van een ander fosfaat om in een kristallijne vaste stof te monteren. Wiskundige vergelijking 2 (-3) + 3 (+2) = 0 helpt deze stoichiometrische verhoudingen voor magnesium en fosfaat te begrijpen.
Als gevolg van deze interacties wordt tribasisch magnesiumfosfaat geproduceerd: mg3(PO4))2. Waarom is Tribasic? Omdat hij in staat is om het equivalent van drie H te accepteren+ Om de H opnieuw te vormen3Po4:
Po43-(AC) + 3H+(AC) H3Po4(AC)
Magnesiumfosfaten met andere kationen
Compensatie van negatieve ladingen kan ook worden bereikt met de deelname van andere positieve soorten.
Bijvoorbeeld om de PO te neutraliseren43-, De k -ionen+, NA+, RB+, NH4+, enz., Ze kunnen ook tussenbeide komen en samengestelde (x) mgpo vormen4. Als X gelijk is aan NH4+, Het watervrije Struvite -mineraal wordt gevormd (NH4) MGPO4.
Geven. Dankzij dit kunnen talloze magnesiumfosfaatkristallen worden gesynthetiseerd (NA3RBMG7(PO4))6, Bijvoorbeeld).
Structuur

Het superieure beeld illustreert de interacties tussen mg -ionen2+ en PO43- die de kristallijne structuur definiëren. Het is echter slechts een beeld dat eerder de tetraëdrische geometrie van fosfaten aantoont. Vervolgens impliceert de kristallijne structuur fosfaat en magnesiumbollen tetraëderra.
In het geval van MG3(PO4))2 watervrij, de ionen nemen een rhombohedrale structuur aan, waarin de Mg2+ wordt gecoördineerd met zes atomen van O.
Het bovenstaande wordt geïllustreerd in het onderste beeld, met de dimensie dat de blauwe bollen kobalt zijn, die ze gewoon veranderen voor de groene sferen van magnesium:
Kan u van dienst zijn: niet -ferromegeringen: structuur, eigenschappen, gebruik, voorbeelden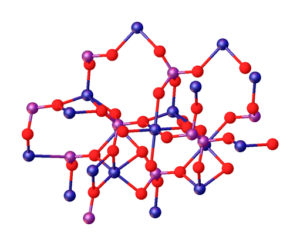
Net in het midden van de structuur kan octaedro gevormd door de zes rode bollen rond de blauwachtige bol worden gevonden.
Ook kunnen deze kristallijne structuren watermoleculen accepteren, waardoor magnesiumfosfaathydraten worden gevormd.
Dit komt omdat ze waterstofbruggen vormen met fosfaationen (HOH-O-PO33-)). Bovendien kan elk fosfaation maximaal vier waterstofbruggen accepteren; dat wil zeggen vier watermoleculen.
Zoals de MG3(PO4))2 Het heeft twee fosfaten, kan acht watermoleculen accepteren (wat gebeurt met het Bobierrite Mineral). Op hun beurt kunnen deze watermoleculen waterstofbruggen vormen met anderen of interageren met de positieve MG -centra2+.
Eigenschappen
Het is een witte vaste stof, die kristallijne rhombische platen vormt. Het heeft ook geen geur en smaak.
Het is zeer onoplosbaar in water, zelfs als het heet is, vanwege zijn grote kristallijne netwerkergie; Dit is het product van de sterke elektrostatische interacties tussen de MG -veelzijdige ionen2+ en PO43-.
Dat wil zeggen, wanneer de ionen veelzijdig zijn en hun ionische radio's niet veel in grootte variëren, vertoont de vaste stof weerstand tegen de oplossing.
Smelt tot 1184 ºC, wat ook indicatief is voor de sterke elektrostatische interacties. Deze eigenschappen variëren afhankelijk van hoeveel moleculen van water absorberen, en of fosfaat zich in sommige van zijn geprotoneerde vormen bevindt (HPO42- of h2Po4-)).
Gebruik/toepassingen
Laxeermiddel
Het is gebruikt als laxerend voor staten van constipatie en maagzuurgraad. De schadelijke bijwerkingen ervan - gemanifesteerd door het genereren van diarree en braken - hebben echter hun gebruik beperkt. Bovendien zal het waarschijnlijk schade veroorzaken aan het maagdarmkanaal.
Kan u dienen: Moleculaire zuurstof: structuur, eigenschappen, gebruikBotherstel
Het gebruik van magnesiumfosfaat bij beperken van botweefsel wordt momenteel onderzocht, waarbij de toepassing van de Mg wordt onderzocht (H2Po4))2 Als cement.
Deze vorm van magnesiumfosfaat voldoet aan de vereisten hiervoor: het is biologisch afbreekbaar en histocompatibel. Bovendien wordt het gebruik ervan in de regeneratie van botweefsel aanbevolen voor zijn weerstand en snelle instelling.
Materiaal voor orthopedie
Het gebruik van amorf magnesiumfosfaat (AMP) wordt geëvalueerd als biologisch afbreekbaar en niet -exotherme orthopedisch cement. Om dit cement te genereren, wordt het AMP -poeder met polyvinylalcohol gemengd om een stopverf te vormen.
In levende wezens
De belangrijkste functie van magnesiumfosfaat is om te dienen als een MG -bijdrage aan levende wezens. Dit element komt tussenbeide in talloze enzymatische reacties zoals katalysator of tussenpersoon, die essentieel zijn voor het leven.
Een MG -deficiëntie bij mensen wordt geassocieerd met de volgende effecten: afname van Ca -niveaus, hartfalen, retentie van NA, verlaagde K -niveaus, aritmieën, aanhoudende spiercontracties, braken, misselijkheid, lage circulerende niveaus van parathyroïde hormoon en maag- en menstrurale krampen, onder andere.
Referenties
- Minerale gegevens publiceren. (2001-2005). Bobierrite. Hersteld van HandbookofMineralogy.borg
- Sahar Mousa. (2010). Studie over synthese van magnesiumfosfaatmaterialen. Phosporus Research Bulletin Vol. 24, pp 16-21.
- Wikipedia. (2018). Magnesiumfosfaattribasisch. Opgehaald van.Wikipedia.borg
- Pubchem. (2018). Magnesiumfosfaat watervrij. Hersteld van PubChem.NCBI.NLM.NIH.Gov
- Barbie, E., Lin, B., Goel, v.K. En Bhaduri, s. (2016) Evaluatie van op amorf magnesiumfosfaat (AMP) gebaseerde niet-exotherme oftopedisch cement. Biomedische mat. Deel 11 (5): 055010.
- Yu, en., Yu, Ch. En dai, h. (2016). Bereiding van afbreekbaar magnesiumbotcement. Regeneratieve biomaterialen. Deel 4 (1): 231

