Lithiumfluoridestructuur, eigenschappen, het verkrijgen, gebruiken

- 1807
- 44
- Ernesto McKenzie
Hij Lithiumfluoride Het is een anorganische vaste stof waarvan de chemische formule leven is. Wordt gevormd door li -ionen+ en f- die verenigd zijn via een ionische band. Het wordt in kleine hoeveelheden gevonden in verschillende mineralen, vooral silicaten zoals lepidoliet, zeewater en in veel minerale putten.
Het heeft een breed gebruik gehad op optische apparaten vanwege de transparantie in een breed scala van golflengten, van het infraroodspectrum (IR) tot de UV Ultraviolet, door het zichtbare.
 Lepidoliet, mineraal dat kleine hoeveelheden levensfluoride bevat. Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons.
Lepidoliet, mineraal dat kleine hoeveelheden levensfluoride bevat. Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons. Het is ook op apparaten gebruikt om gevaarlijke straling te detecteren in banen waarin mensen deze voor een korte tijd worden blootgesteld. Bovendien wordt het gebruikt als materiaal om aluminium te smelten of om een glas of glazen glas en keramische productie te maken.
Het dient als materiaal om componenten van lithium -ionbatterijen te bedekken en om het eerste verlies van laden hiervan te voorkomen.
[TOC]
Structuur
Lithiumfluoride is een ionische verbinding, dat wil zeggen, gevormd door de unie van het LiCation+ en het anion f-. De kracht die ze bij elkaar houdt, is elektrostatisch en wordt ionische binding genoemd.
Wanneer het lithium wordt gecombineerd, geeft hij een elektron aan fluoride, beide stabieler dan de eerste manier, zoals hieronder uitgelegd.
Het lithiumelement heeft de volgende elektronische configuratie: [hij] 1s2 2s1 En bij het geven van een elektron is de elektronische structuur als volgt: [hij] 1s2 wat veel stabieler is.
Het fluor -element waarvan de elektronische configuratie is: [ne] 1s2 2s2 2 p5, Door het elektron te accepteren is de vorm [ne] 1s2 2s2 2 p6, stabieler.
Nomenclatuur
- Lithiumfluoride
- Fluorolitio
Kan u van dienst zijn: niet -metalen oxiden- Lithiummonofluoride
Eigenschappen
Fysieke staat
Witte vaste stof, die kristalliseert in kubieke structuur, zoals natriumchloride NaCl.
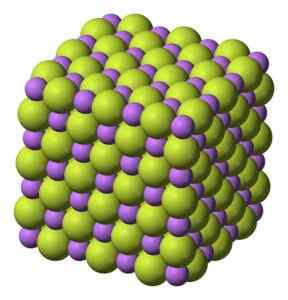 Kubieke structuur van LIF lithiumfluoridekristallen. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons.
Kubieke structuur van LIF lithiumfluoridekristallen. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons. Molecuulgewicht
26 g/mol
Smeltpunt
848.2 ºC
Kookpunt
1673 ºC, hoewel het is vervluchtigd bij 1100-1200 ºC
Dikte
2.640 g/cm3
Brekingsindex
1.3915
Oplosbaarheid
Weinig oplosbaar in water: 0,27 g/100 g water bij 18 ºC; 0,134 g/100 g bij 25 ºC. Oplosbaar in zuur medium. Onoplosbaar in alcohol.
Andere eigenschappen
De dampen hebben dimicsoorten (leven)2 en Trimeric (LIF)3. Met hf fluorhorinezuur vorm LiHf lithium2; Met lithiumhydroxide vormt het een dubbele levenszout.Lioh.
Verkrijgen en locatie
LIF -lithiumfluoride kan worden verkregen door reactie tussen HF -fluorhoriczuur en LIOH lithiumhydroxide of lithium lithiumcarbonaat2CO3.
Het is echter in kleine hoeveelheden aanwezig in bepaalde mineralen zoals lepidoliet en zeewater.
 Lithiumfluoride wordt in kleine hoeveelheden gevonden in zeewater. Adeeb atwan [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)]. Bron: Wikimedia Commons.
Lithiumfluoride wordt in kleine hoeveelheden gevonden in zeewater. Adeeb atwan [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)]. Bron: Wikimedia Commons. Toepassingen
In optische toepassingen
De LIF wordt gebruikt in de vorm van compacte kristallen in infraroodspectrofotometers (IR) vanwege de uitstekende dispersie die ze hebben in het golflengte -interval tussen 4000 en 1600 cm-1.
LIF LIF -kristallen worden verkregen uit verzadigde oplossingen van dit zout. Het kan natuurlijke fluorietkristallen vervangen in verschillende soorten optische apparaten.
Grote en pure kristallen worden gebruikt in optische systemen voor ultraviolet licht (UV), zichtbare en IR- en röntgenmonochromators (0,03-0,38 nm).
 Life Lif Fluoruro Crystal, in een beker. V1adis1av [Public Domain]. Bron: Wikimedia Commons.
Life Lif Fluoruro Crystal, in een beker. V1adis1av [Public Domain]. Bron: Wikimedia Commons. Het wordt ook gebruikt als optisch coatingmateriaal voor het UV -gebied vanwege de brede optische band, groter dan die van andere metalen fluoriden.
Het kan u van dienst zijn: alkalinotherrous metalenZijn transparantie in de verre UV (90-200 nm) maakt het ideaal als een beschermende coating in aluminium spiegels (AL). LIF/AL -spiegels hebben gebruik in optische telescoopsystemen voor ruimtetoepassingen.
Deze coatings worden bereikt door fysieke afzetting van stoom en laagafzetting op atoomniveau.
In ioniserende of gevaarlijke stralingsdetectoren
Lithiumfluoride is veel gebruikt in thermoluminescente detectoren voor fotonen, neutronen en β (bèta) straling.
Thermoluminescente detectoren houden de stralingsenergie bij zich wanneer deze hieraan wordt blootgesteld. Vervolgens laat bij het verwarmen ze de energie vrij die is opgeslagen in lichtvorm.
Voor deze toepassing is de LIF over het algemeen gedateerd met magnesiumonzuiverheden (MG) en titanium (Ti). Deze onzuiverheden genereren bepaalde energieniveaus die werken als gaten waarbij de door straling vrijgegeven elektronen vastzitten. Wanneer het materiaal vervolgens werd verwarmd, keren deze elektronen terug naar hun oorspronkelijke energietoestand die licht uitzenden.
De intensiteit van het uitgezonden licht hangt rechtstreeks af van de energie die door het materiaal wordt geabsorbeerd.
Thermoluminescente detectoren van LIF zijn succesvol getest om complexe stralingsvelden te meten, zoals die aanwezig in de grote Hadron Collider of LHC (voor zijn acroniem voor Engels Large Hadron Collider), gelegen in de Europese Organisatie voor Nucleair Research, bekend als CERN (voor haar acroniem Frans Conseil européen giet de recherche nucleaire)).
Straling in de ervaringen uitgevoerd in dat onderzoekscentrum aanwezig hadronen, neutronen en elektronen/positronen, naast andere soorten subatomaire deeltjes, die allemaal kunnen worden gedetecteerd met het leven.
Als materiaal om de lithiumbatterijkathode te prelieten
Het leven is met succes getest in de vorm van nanocomposieten met kobalt (CO) en ijzer (geloof) als materialen voor prelitiatie (vertaling van het Engels Prelithiatie) van het lithium -ion batterij kathodemateriaal.
Kan u van dienst zijn: ethyletherTijdens de eerste belastingscyclus of vormingsfase van een lithiumionbatterij wordt de organische elektrolyt afgebroken om een vaste fase op het oppervlak van de anode te vormen.
Dit proces verbruikt lithium van de kathode en vermindert energie tussen 5 en 20% van de totale capaciteit van de lithiumionbatterij.
Om deze reden is de elektrochemische prelitiatie van de kathode onderzocht, die een elektrochemische extractie van het lithium van de nanokompot genereert, die werkt als een lithiumdonor, waardoor de consumptie van lithium van de kathode wordt vermeden.
Nanocomposieten LIF/CO en LIF/FE hebben een hoge capaciteit om lithium aan de kathode te doneren, is gemakkelijk te synthetiseren, stabiel in omgevingsomstandigheden en batterijverwerking.
 Lithium ion batterij. Auteur: MR.ちゅら さん. Lithium_battery * Fotografie Dag, augustus 2005 * Fotografie Persoon aney. Bron: Wikimedia Commons.
Lithium ion batterij. Auteur: MR.ちゅら さん. Lithium_battery * Fotografie Dag, augustus 2005 * Fotografie Persoon aney. Bron: Wikimedia Commons. In verschillende toepassingen
Lithiumfluoride wordt gebruikt als lasmeter, vooral aluminium, en in lasstangcoatings. Het wordt ook gebruikt in aluminium reductiecellen.
Het wordt veel gebruikt bij de vervaardiging van glas (zoals die van de lenzen) waarin de expansiecoëfficiënt afneemt. Het wordt ook gebruikt in de productie van keramiek. Bovendien heeft het gebruik bij de productie van emaille en glasachtige vernissen.
Het leven is een brandstofcomponent voor raketten en brandstoffen voor bepaalde soorten reactoren.
LIF wordt ook gebruikt in licht die diodes of fotovoltaïsche componenten emitteert, voor de injectie van elektronen in interne lagen.
Referenties
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Fluoride lithium. Hersteld van: pubchem.NCBI.NLM.NIH.Gov.
- OBRYK, B. et al. (2008). De respons van verschillende soorten TL-lithiumfluoridedetectoren op high-anergy gemengde stralingsvelden. Stralingsmetingen 43 (2008) 1144-1148. Hersteld van Scientedirect.com.
- Zon, en. et al. (2016). In situ chemische synthese van lithiumfluoride/metaal nanocomposiet voor prelithiatie van hoge capaciteit van kathoden. Nano Letters 2016, 16, 2, 1497-1501. Hersteld van pubs.ACS.borg.
- Hennessy, J. en Nikzad, s. (2018). Atoomlaagafzetting van optische lithiumfluoride optische coatings voor de ultraviolet. Anorganics 2018, 6, 46. MDPI hersteld.com.
- « 10 Wetenschappelijke experimenten voor fysische secundaire, chemie, biologie
- Methylmalonzuurstructuur, eigenschappen, synthese, gebruik »

