Calciumfluoride (CAF2) structuur, eigenschappen, gebruik

- 702
- 16
- Irving McClure I
Hij calciumfluoride Het is een anorganische vaste stof gevormd door een calciumatoom (CA) en twee fluoratomen (F). De chemische formule is CAF2 En het is een kristallijn grijs -witte vaste stof.
In de natuur wordt het gevonden in de fluorieterts of spatfluor. Het bestaat van nature in botten en tanden. Fluorite -mineraal is de belangrijkste bron die wordt gebruikt om andere fluorverbindingen te verkrijgen.
 Calciumfluoride calcium2 stevig. W: Gebruiker: Walkerma in juni 2005. Bron: Wikimedia Commons.
Calciumfluoride calcium2 stevig. W: Gebruiker: Walkerma in juni 2005. Bron: Wikimedia Commons. Bovendien de koffie2 Het wordt gebruikt voor cariëspreventie in de tanden, dus het wordt toegevoegd aan materialen die door tandartsen worden gebruikt om ze te genezen. In feite wordt calciumfluoride ook toegevoegd aan drinkwater (water dat kan worden gedronken) zodat de bevolking profiteert bij het innemen en poetsen van de tanden.
Café2 Het wordt gebruikt in grote kristallen in optische apparatuur en camera's. Het wordt ook gebruikt in kleine apparaten die dienen om te detecteren hoeveel een persoon is blootgesteld aan radioactiviteit.
[TOC]
Structuur
Calciumfluoride calcium2 Het is een ionische verbinding gevormd door een CA -calciumkation2+ en twee fluoride fantheden-. Sommige informatiebronnen geven echter aan dat hun links een bepaald covalent karakter hebben.
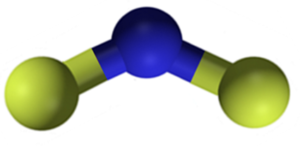 Calciumfluoridestructuur2. Blauw: calcium; Gele fluor. Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons.
Calciumfluoridestructuur2. Blauw: calcium; Gele fluor. Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons. Nomenclatuur
Calciumfluoride
Eigenschappen
Fysieke staat
Kleurend vast tot grijsachtig wit met kubieke kristallijne structuur.
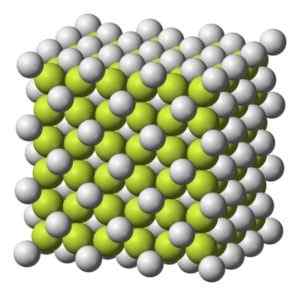 Kubieke kristallijne structuur van koffie2. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons.
Kubieke kristallijne structuur van koffie2. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons. Molecuulgewicht
78.07 g/mol
Smeltpunt
1418 ºC
Kookpunt
2533 ºC
Dikte
3.18 g/cm3 bij 20 ° C.
Brekingsindex
1.4328
Oplosbaarheid
Het is onoplosbaar in water bij 20 ° C. Bijna onoplosbaar bij 25 ° C: 0,002 g/100 ml water. Enigszins zuur oplosbaar.
Chemische eigenschappen
De oxiderende of reducerende eigenschappen zijn erg zwak, maar deze reacties kunnen optreden. Hoewel meestal in zeer weinig gevallen.
Het is inert voor organische chemische verbindingen en veel zuren, waaronder HF -fluorhorinezuur. Het lost langzaam op in salpeterzuur3.
Kan u van dienst zijn: Millikan Experiment: procedure, uitleg, belangHet is niet ontvlambaar. Reageert niet snel met lucht of water.
Vanwege de kleine affiniteit voor water, hoewel het wordt blootgesteld aan een hoog percentage vocht, heeft het er zelfs geen invloed op een maand bij normale kamertemperatuur.
In aanwezigheid van vocht worden de wanden van hun kristallen langzaam opgelost bij temperaturen boven 600 ° C. In droge omgevingen kan het tot ongeveer 1000 ° C worden gebruikt zonder aanzienlijk te beïnvloeden.
Aanwezigheid in de natuur
Calciumfluoride calcium2 Het wordt van nature aangetroffen in fluorieterts of spatfluoride.
Hoewel de koffie2 Puur is kleurloos, fluorietmineraal wordt vaak gekleurd door de aanwezigheid van elektronen die in de "gaten" van de kristallijne structuur zijn gevangen.
Dit mineraal wordt zeer gewaardeerd vanwege zijn glazige helderheid en verscheidenheid aan kleuren (paars, blauw, groen, geel, kleurloos, bruin, roze, zwart en roodachtig oranje). Er wordt gezegd dat het "het meest gekleurde mineraal ter wereld" is.
 Fluoriet van een mijn in Frankrijk. Toulouse Muséum [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons.
Fluoriet van een mijn in Frankrijk. Toulouse Muséum [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons. Fluoriet (blauwe kristallen) van het natuurlijke museum van Milaan. Giovanni Dall'orto [CC BY-SA 2.5 it (https: // creativeCommons.Org/licenties/by-sa/2.5/IT/akte.in)]. Bron: Wikimedia Commons.
Fluoriet (blauwe kristallen) van het natuurlijke museum van Milaan. Giovanni Dall'orto [CC BY-SA 2.5 it (https: // creativeCommons.Org/licenties/by-sa/2.5/IT/akte.in)]. Bron: Wikimedia Commons. Fluoriet van een mijn in Engeland. Didier Descuens [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons.
Fluoriet van een mijn in Engeland. Didier Descuens [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons. Fluoriet van een mijn in Frankrijk. Didier Descuens [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons.
Fluoriet van een mijn in Frankrijk. Didier Descuens [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons.
 Fluoriet van een mijn in de VS. Auteur: Oliveira Jurema. Bron: Wikimedia Commons.
Fluoriet van een mijn in de VS. Auteur: Oliveira Jurema. Bron: Wikimedia Commons. Calciumfluoride wordt ook gevonden in botten in hoeveelheden tussen 0,2 en 0,65%, en ook in het glazuur van de tanden in 0,33-0,59%.
Toepassingen
- Bij het verkrijgen van fluorideverbindingen
Fluorita Caf2 Het is de basis- of meerderheidsbron van fluoride wereldwijd. Het is de grondstof om bijna alle fluorverbindingen te bereiden.
De belangrijkste hiervan is HF -fluorhorinezuur, waaruit de andere fluorge -verbindingen worden bereid. Het fluoride -ion f- Het wordt uit het mineraal afgegeven door reactie hiervan met geconcentreerd zwavelzuur H2SW4:
Kan u van dienst zijn: isomeriaCafé2 (Solid) + H2SW4 (vloeistof) → Case4 (vast) + 2 hf (gas)
- In tandenzorg
Calciumfluoride calcium2 Het is een agent voor cariëspreventie. Het wordt gebruikt om drinkbare wateren (wateren die te drinken kunnen worden) te fluoriseren met dat doel.
Bovendien zijn de lage fluoride -concentraties F- (in de volgorde van 0,1 delen per miljoen) die worden gebruikt in dentifric -pasta's en mondwater hebben aangetoond een diep positief effect te hebben op de preventieve tandverzorging van cariës.
 Calciumfluoride helpt bij het voorkomen van cariës. Auteur: Annalize Batista. Bron: Pixabay.
Calciumfluoride helpt bij het voorkomen van cariës. Auteur: Annalize Batista. Bron: Pixabay. CAF -nanodeeltjes2 effectiever
Hoewel fluoriden worden gebruikt in tandpasta's en spoelen, zorgt de lage concentratie calcium (Ca) in speeksel ervoor dat koffieafzettingen zich niet vormen2 in de tanden op de meest effectieve manier mogelijk.
Dat is de reden waarom een manier is om koffie te verkrijgen is bedacht2 Als nanodeeltjes.
Hiervoor wordt een droger gebruikt door Rocío (uit het Engels Sproeidroger) Waar twee oplossingen (een van Ca (OH) calciumhydroxide2 en een van ammoniumfluoride NH4F) ze mengen ze terwijl ze worden gespoten in een camera met hete luchtstroom.
Dan treedt de volgende reactie op:
CA (oh)2 + NH4F → CAF2 (Solid) + NH4Oh
De NH4OH vervluchtig als NH3 en h2O en de CAF -nanodeeltjes blijven2.
Deze hebben een hoge reactiviteit en een grotere oplosbaarheid, waardoor ze effectiever worden voor seineralisatie van tanden en als anticariums.
- In lens voor optische apparatuur
Calciumfluoride wordt gebruikt om optische elementen te bouwen zoals prisma's en spectrofotometers van infrarood en ultraviolet licht (UV).
Met deze apparaten kan de hoeveelheid licht die door een materiaal wordt opgenomen, meten wanneer het erdoorheen gaat.
Café2 Het is transparant in deze gebieden van het lichtspectrum, heeft een extreem lage brekingsindex en maakt het mogelijk om een efficiëntere resolutie te verkrijgen dan die van NaCl in de interval 1500-4000 cm-1.
Kan u van dienst zijn: paramagnetismeDankzij de chemische stabiliteit kan ongunstige omstandigheden ondersteunen, zodat de optische elementen van CAF2 Ze worden niet aangevallen. Het heeft ook een hoge hardheid.
In camera's
Sommige camerafabrikanten gebruiken koffielenzen2 Kunstmatig kristalliseerd om lichte dispersie te verminderen en een uitstekende correctie van kleurenvervorming te bereiken.
 Sommige camera's hebben CAF -calciumfluoride lenzen2 Om kleuren vervorming te verminderen. Bill Ebbesen [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)]. Bron: Wikimedia Commons.
Sommige camera's hebben CAF -calciumfluoride lenzen2 Om kleuren vervorming te verminderen. Bill Ebbesen [CC door 3.0 (https: // creativeCommons.Org/licenties/door/3.0)]. Bron: Wikimedia Commons. - In de metallurgische industrie
Café2 Het wordt gebruikt als stichtingsmiddel in de metallurgische industrie, omdat het een bron van calcium is onoplosbaar in water en daarom effectief is in zuurstofgevoelige toepassingen.
Het wordt gebruikt om ijzer en staal te smelten en te verwerken. Dit is gebaseerd op het feit dat het een smeltpunt heeft dat vergelijkbaar is met dat van ijzer en ook dat het oxiden en metalen kan oplossen.
- In radioactiviteitsdetectoren of gevaarlijke straling
Café2 Het is een thermoluminescerend materiaal. Dit betekent dat het straling in de elektronen van zijn kristallijne structuur kan absorberen en wanneer het wordt verwarmd om het in de vorm van licht af te geven.
Dit uitgestraalde licht kan worden gemeten door een elektrisch signaal. Dit signaal is evenredig met de hoeveelheid straling die door het materiaal is ontvangen. Betekent dat hoe groter de hoeveelheid straling, hoe groter de hoeveelheid licht die later wordt uitgestoten wanneer deze wordt verwarmd.
Daarom het CAF2 Het wordt gebruikt in de zo -called persoonlijke tweeimeters, die worden gebruikt door mensen die worden blootgesteld aan gevaarlijke straling en u wilt weten hoeveel straling ze in een periode van tijd hebben ontvangen.
- Andere gebruiken
- Het wordt gebruikt als een katalysator in chemische reacties van uitdroging en dehydrogenering voor de synthese van organische verbindingen.
- Het wordt gebruikt in laselektroden van lassen. Een sterker lassen wordt verkregen dan met zure elektroden. Deze elektroden zijn nuttig bij de vervaardiging van schepen en hogedrukstalen containers.
- Als voedselsupplement in extreem lage hoeveelheden (PPM of delen per miljoen).
 Man lassen. Elektroden met calciumfluoride koffie2 Ze vormen sterkere lassen. William M. Bord jr. [Publiek domein]. Bron: Wikimedia Commons.
Man lassen. Elektroden met calciumfluoride koffie2 Ze vormen sterkere lassen. William M. Bord jr. [Publiek domein]. Bron: Wikimedia Commons. Referenties
- Pirmradian, m. en HOOSHMAND, T. (2019). Remineralisatie en antibacteriële mogelijkheden van op hars gebaseerde tandheelkundige nanocomposieten. Synthese en karakterisering van calciumfluoride (CAF2)). In toepassingen van nanocomposietmaterialen in tandheelkunde. Hersteld van Scientedirect.com.
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Fluoride calcium. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Weman, k. (2012). Metal Arc Manual (MMA) lassen met gecoate elektroden. In lasprocessen Handbook (tweede editie). Hersteld van Scientedirect.com.
- Hanning, m. en Hanning, c. (2013). Nanobiomaterialen in preventieve tandheelkunde. Nanosised fluoride calcium. In nanobiomaterialen in klinische tandheelkunde. Hersteld van Scientedirect.com.
- Ropp, r.C. (2013). Groep 17 (H, F, CL, BR, I) Alkalische aardverbindingen. Fluoride calcium. In encyclopedie van de alkalische aardverbindingen. Hersteld van Scientedirect.com.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Valkovic, V. (2000). Metingen van radioactiviteit. In radioactiviteit in de omgeving. Themoluminescente detectoren (TLD's). Hersteld van Scientedirect.com.
- « Nitruro de Boro (BN) structuur, eigenschappen, verkrijgen, gebruik
- Siliciumoxide (SiO2) structuur, eigenschappen, gebruik, verkrijgen »

