Siliciumoxide (SiO2) structuur, eigenschappen, gebruik, verkrijgen

- 1436
- 329
- Irving McClure I
Hij siliciumoxide Het is een anorganische vaste stof gevormd door de vereniging van een siliciumatoom en twee zuurstof. De chemische formule is SIO2. Deze natuurlijke verbinding wordt ook silicium of siliciumdioxide genoemd.
De SIO2 Het is het meest voorkomende mineraal in de aardkorst, omdat het zand bestaat uit silica. Volgens zijn structuur kan silica kristallijn of amorf zijn. Het is onoplosbaar in water, maar lost op in alkaliërs en in fluorhorinezuur HF.
 Het zand is een bron van siliciumdioxide Sio2. ರವಿಮುಂ [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons.
Het zand is een bron van siliciumdioxide Sio2. ರವಿಮುಂ [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons. De SIO2 Het is ook aanwezig in de structuur van bepaalde planten, bacteriën en schimmels. Ook in skeletten van mariene organismen. Naast het zand zijn er ook andere soorten stenen die silica zijn.
Silica heeft een zeer wijdverbreid gebruik van verschillende functies. Het meest voorkomende gebruik is als filtermateriaal van vloeistoffen zoals oliën en olieproducten, drankjes zoals bier en wijn, evenals vruchtensappen.
Maar het heeft veel andere toepassingen. Een van de meest bruikbare en belangrijke is bij de productie van bioactief glas, waardoor "steiger" mogelijk is waar botcellen groeien om ontbrekende botonderdelen te produceren als gevolg van ongeval of ziekte.
[TOC]
Structuur
Silicio sio dioxide2 Het is een drie -atoommolecuul, waarin het siliciumatoom is gekoppeld aan twee zuurstofatomen met covalente bindingen.
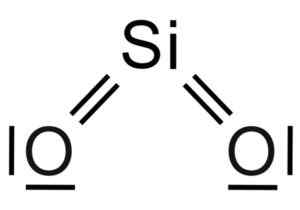 Chemische structuur van het SIO -molecuul2. Grasso Luigi [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons.
Chemische structuur van het SIO -molecuul2. Grasso Luigi [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons. De structurele eenheid van massief silica als zodanig is een tetraëder waarbij een siliciumatoom wordt omgeven door 4 zuurstofatomen.
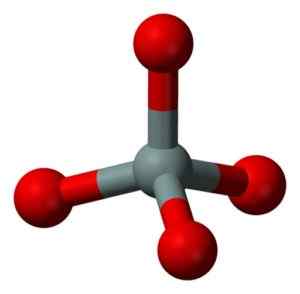 Structurele eenheid van vast silica: grijs = silicium, rood = zuurstof. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons.
Structurele eenheid van vast silica: grijs = silicium, rood = zuurstof. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons. De tetrahedra bindt aan elkaar en deelt de zuurstofatomen van hun aaneengesloten hoekpunten.
Dat is de reden waarom een siliciumatoom in de helft van elk van de 4 zuurstofatomen deelt en dit verklaart de verhouding in de verbinding van 1 siliciumatoom bij 2 zuurstofatomen (Sio2)).
 Tetrahedra delen zuurstof in de SIO2. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons.
Tetrahedra delen zuurstof in de SIO2. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons. SIO -verbindingen2 Ze zijn verdeeld in twee groepen: kristallijn silica en amorf silica.
Kristallijne siliciumverbindingen hebben structuren met repetitieve patronen van silicium en zuurstof.
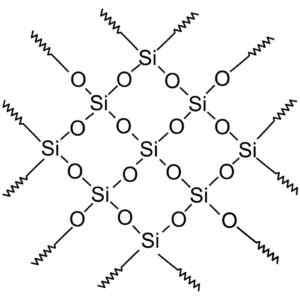 Kristallijn silica heeft repetitieve eenheden. Wersję Rastrową Wykonał Użytkownik Polskiego Projektu Wikipedii: Polyimerek, Zwektoryzował: krzysztof zajączkowski [gfdl (http: // www.GNU.Org/copyleft/fdl.html)]. Bron: Wikimedia Commons.
Kristallijn silica heeft repetitieve eenheden. Wersję Rastrową Wykonał Użytkownik Polskiego Projektu Wikipedii: Polyimerek, Zwektoryzował: krzysztof zajączkowski [gfdl (http: // www.GNU.Org/copyleft/fdl.html)]. Bron: Wikimedia Commons. Alle siliciumkristal kan worden beschouwd als een gigantisch molecuul waar het kristallijne netwerk erg sterk is. Tetrahedra kan op verschillende manieren worden gekoppeld, wat aanleiding geeft tot verschillende kristallijne vormen.
Kan u van dienst zijn: Bravais Networks: Concept, Kenmerken, voorbeelden, oefeningenIn amorf silica zijn de structuren willekeurig gekoppeld, zonder een regelmatig patroon tussen de moleculen te volgen en deze zijn in een andere ruimtelijke relatie met elkaar.
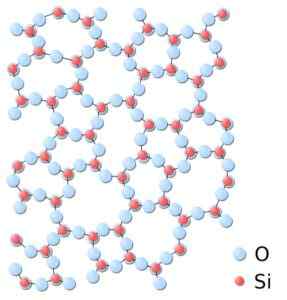 In amorf silica zijn vakbonden niet repetitief of uniform. Silica.SVG: *Silica.JPG: In: Gebruiker: JDrewittderiveVative Work: Matt [Public Domain]. Bron: Wikimedia Commons.
In amorf silica zijn vakbonden niet repetitief of uniform. Silica.SVG: *Silica.JPG: In: Gebruiker: JDrewittderiveVative Work: Matt [Public Domain]. Bron: Wikimedia Commons. Nomenclatuur
-Siliciumoxide
-Siliciumdioxide
-Silica
-Kwarts
-Tridimita
-Cristobalita
-Dioxosilano
Eigenschappen
Fysieke staat
Kleur kleurloos tot grijs.
 SIO -monster2 zuiver. LHCHEM [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons.
SIO -monster2 zuiver. LHCHEM [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons. Molecuulgewicht
60.084 g/mol
Smeltpunt
1713 ºC
Kookpunt
2230 ºC
Dikte
2,17-2,32 g/cm3
Oplosbaarheid
Onoplosbaar in water. Amorfe silica is oplosbaar in alkalisten, vooral als het fijn is verdeeld. Oplosbaar in fluorhorinezuur HF.
Amorfe silica is minder hydrofiel, dat wil zeggen minder gerelateerd aan water dan de kristallijn.
Chemische eigenschappen
De SIO2 o Silica is in wezen inert voor de meeste stoffen, het is heel weinig reactief.
Vertisters de aanval van de chloor CL2, Bromo Br2, Waterstof h2 en van de meeste zuren bij kamertemperatuur of iets hoger. Wordt aangevallen door fluor f2, HF Fluorhorhorinezuur en alkalis zoals natriumcarbonaat2CO3.
De SIO2 Het kan worden gecombineerd met metaalelementen en oxiden om silicaten te vormen. Als silica smelt met alkalische metaalcarbonaten bij ongeveer 1300 ° C, worden alkalinesilicaten verkregen en CO2.
Het is geen brandstof. Het heeft een lage thermische geleidbaarheid.
Aanwezigheid in de natuur
De belangrijkste silica -bron in de natuur is zand.
De SIO2 o Silica is in de vorm van drie kristallijne variëteiten: kwarts (de meest stabiele), Tridimita en Cristobalita. Amorfant voor silica zijn de agata, de Jaspe en de Ónice. Het opaal is een amorf gehydrateerd silica.
Er is ook het zo -aangedekte biogene silica, dat wil zeggen, die is gegenereerd door levende organismen. Bronnen van dit type silica zijn bacteriën, schimmels, diatomeeën, zeeponzen en planten.
De heldere en harde delen van de bamboe en het rietje bevatten silica, en de skeletten van sommige mariene organismen hebben ook een groot deel van silica; De belangrijkste zijn echter diatomators.
Diatomea -landen zijn geologische producten van vervallen eencellige organismen (algen).
Kan u van dienst zijn: kosmisch stofAndere soorten natuurlijk silica
In de natuur zijn er ook de volgende variëteiten:
- Glasachtige silicanen die vulkanisch glas zijn
- De Milleritas die natuurlijk glas zijn, geproduceerd door de fusie van kiezelachtig materiaal onder de impact van meteorieten
- Het gesmolten silica dat wordt verwarmd silica tot de vloeistof en gekoeld fase zonder een kristallisch toe te staan
Het verkrijgen van
Silica uit arena's wordt rechtstreeks van de steengroeven verkregen.
 Arena Quarry in Californië. Ruff Tux Cream Puff [CC0]. Bron: Wikimedia Commons.
Arena Quarry in Californië. Ruff Tux Cream Puff [CC0]. Bron: Wikimedia Commons. Het diatomiet of diatomeeën worden ook op deze manier verkregen, met behulp van vergelijkbare graafmachines en apparatuur.
Amorfe silica wordt bereid op basis van waterige oplossingen van alkalische metalen silicaat (zoals natrium Na) door neutralisatie met zuur, zoals zwavelzuur H2SW4, HCl -zoutzuur of koolstofdioxide2.
Als de uiteindelijke pH van de oplossing neutraal of alkalisch is, wordt neergeslagen silica verkregen. Als de pH zuur is, wordt gel -silica verkregen.
Pyrogene silica wordt bereid door verbranding van een vluchtige siliciumverbinding, meestal siliciumsicl -tetrachloride4. Het neergeslagen silica wordt verkregen uit een waterige oplossing van silicaten waaraan zuur wordt toegevoegd.
Colloïdaal silica is een stabiele dispersie van amorfe siliciumcolloïdale deeltjes in een waterige oplossing.
Toepassingen
In verschillende toepassingen
Silica of Sio2 Het heeft een breed scala aan functies, het dient bijvoorbeeld als schurende, absorberend, antiapelmazante, gevuld, opacerend en de voorkeur geven aan de opschorting van andere stoffen, naast vele andere wijzen.
Het wordt bijvoorbeeld gebruikt:
-In glas, keramische, refractaire, schurende en oplosbare glasproductie
-Verkleuring en zuivering van oliën en olieproducten
-In mallen voor gieterij
-Als antiapelmazante van allerlei soorten poeders
-Als antispumant
-Om vloeistoffen zoals droge wassende oplosmiddelen te filteren, het water van de zwembaden en gemeentelijk en industrieel afvalwater
-Bij de vervaardiging van warmteisolatoren, brandwerende bakstenen en verpakkingsmaterialen die resistent zijn tegen vuur en zuren
-Als het invullen van de vervaardiging van papieren en kaarten, om ze meer resistent te maken
-Zoals gevuld met schilderijen om de stroom en kleur te verbeteren
-In materialen voor metaalpolijsten en hout, omdat ze ze schuurviviteit geven
-In chemische analyse laboratoria in chromatografie en als absorberend
-Als antiapelmazante van insecticide en agrochemische formules, om pesticidaal te slijpen en als een drager van de actieve verbinding
-Als katalysatorondersteuning
-Als vulling om synthetisch rubber en rubbers te versterken
Kan u van dienst zijn: longitudinale golven: kenmerken, verschillen, voorbeelden-Als drager van vloeistoffen in dierlijk voedsel
-In print inkten
-Als droogmiddel en adsorbens, in de vorm van silicagel
-Als additief in cement
-Als huisdierzand
-In micro -elektronica isolatoren
-In thermoptische schakelaars
 Silicagel. Kenpei [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]]. Bron: Wikimedia Commons.
Silicagel. Kenpei [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]]. Bron: Wikimedia Commons. In de voedingsindustrie
Een amorf silica is opgenomen in verschillende voedingsmiddelen als een multifunctioneel direct ingrediënt in verschillende soorten voedsel. U mag niet hoger zijn dan 2% van het afgewerkte voedsel.
Het dient bijvoorbeeld als antiapelmazante (om te voorkomen dat bepaalde voedingsmiddelen blijven plakken), als een stabilisator bij de productie van bier, als antiprecipitator, om wijn, bier en vruchtensappen of groenten te filteren.
 Team voor wijnfiltering met diatomeeën (SIO2)). Fabio Ingroso [CC door 2.0 (https: // creativeCommons.Org/licenties/door/2.0)]. Bron: Wikimedia Commons.
Team voor wijnfiltering met diatomeeën (SIO2)). Fabio Ingroso [CC door 2.0 (https: // creativeCommons.Org/licenties/door/2.0)]. Bron: Wikimedia Commons. Het fungeert als een vloeistofabsorberend in sommige voedingsmiddelen en component van microcapsules voor smaakolie.
Bovendien de SIO2 Amorfe wordt toegepast via een speciaal proces op het oppervlak van de kunststoffen van artikelen om voedsel in te pakken, die als barrière fungeert.
In de farmaceutische industrie
Het wordt toegevoegd als een antiapelmazante middel, verdikking, gelering en als een excipiënt, dat wil zeggen als assistent om verschillende medicijnen en vitamines te vormen.
In de cosmetica -industrie en persoonlijke verzorging
Het wordt gebruikt in een veelvoud aan producten: in gezichtspoeders, oogschaduwen, oog eyeliners, lippenstiften, kleur-, make -upopvang, talk, voetpoeders, haarverf en bleekmiddel en bleekmiddel.
Ook in oliën en badzout, schuimbaden, handen en lichaamscrème.
Ook in nachthydratatiecrèmes, helderheid en nagelverf.
In therapeutische toepassingen
De SIO2 Het is aanwezig in bioactief of biovidrios glas waarvan de belangrijkste kenmerk is dat ze chemisch kunnen reageren met de biologische omgeving die hen omringt, waardoor een sterke en duurzame schakel wordt gevormd met het levende weefsel.
Dit type materiaal dient om botvervangers te maken, zoals die van het gezicht, zoals "steiger" waarin botcellen zullen groeien. Ze hebben een goede biocompatibiliteit aangetoond met zowel botten als zachte weefsels.
Deze biovidrios zullen het toelaten om botten van het gezicht te herstellen naar mensen die ze per ongeluk of ziekte hebben verloren.
Risico's
Zeer dunne silica -deeltjes kunnen in de lucht worden gesuspendeerd en niet -explosieve poeders vormen. Maar dit stof kan de huid en ogen irriteren. De inademing ervan veroorzaakt irritatie van luchtwegen.
Bovendien veroorzaakt de inhalatie van siliciumstofstof op lange termijn schade aan de longen, silicose genoemd.
Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Siliciumdioxide. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Da silva, m.R. et al. (2017). Groene extractietechnieken. Sorbnts op basis van silica. Bij het begrijpen van analytische chemie. Hersteld van Scientedirect.com.
- Ylänen, h. (editor). (2018). Bioactieve bril: materialen, eigenschappen en toepassingen (tweede editie). Elsevier. Hersteld uit boeken.Google.co.gaan.
- Windholz, m. et al. (Editors) (1983) De Merck Index. Een encyclopedie van chemicaliën, drarugs en biologicals. Tiende editie. Merck & Co., Inc.
- Mäkinen, J. En Suni, T. (2015). Dikke film Soi Wafers. In Handbook of Silicon Based Mems Materials and Technologies (tweede editie). Hersteld van Scientedirect.com.
- Sirleto, l. et al. (2010). Thermo-optische schakelaars. Silicium nanokristallen. Hersteld van Scientedirect.com.
- « Calciumfluoride (CAF2) structuur, eigenschappen, gebruik
- 275 pyropo's voor romantische en sexy mannen »

