Fluorgeschiedenis, eigenschappen, structuur, verkrijgen, risico's, gebruik
- 3695
- 1032
- Miss Herman Russel
Hij fluor Het is een chemisch element dat wordt weergegeven met het F -symbool en de koppen groep 17, waartoe de halogenen behoren. Het wordt onderscheiden boven de andere elementen van het periodiek systeem, omdat het de meest reactieve en elektronegatieve is; reageert bijna met alle atomen, dus het vormt talloze zouten en organisatorische verbindingen.
Onder normale omstandigheden is het een lichtgeel gas, dat kan worden verward met geelachtig groen. In vloeibare toestand, weergegeven in het onderste beeld, wordt de gele kleur een beetje meer intensiveerd, wat volledig verdwijnt wanneer het in zijn vriespunt stolt.
 Vloeibare fluor in een testbuis. Bron: fulvio314 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Vloeibare fluor in een testbuis. Bron: fulvio314 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Het is zo'n reactiviteit, ondanks het vluchtige van zijn gas, dat gevangen blijft in de korst van de aarde; vooral in de vorm van fluorietmineraal, bekend om zijn violette kristallen. Evenzo maakt de reactiviteit het een potentieel gevaarlijke stof; Reageer krachtig met alles wat aanraakt en brandt in vlammen.
Veel van de afgeleide producten kunnen echter onschadelijk en zelfs voordelig zijn, afhankelijk van hun toepassingen. Het meest populaire gebruik van fluoride, toegevoegd in zijn ionische of minerale vorm (zoals fluoridezouten), bestaat bijvoorbeeld uit de bereiding van tandheelkundige pasta's met fluoride, die helpen bij het beschermen van het tandheelkundige email.
Fluorine presenteert de eigenaardigheid dat hoge aantallen of oxidatietoestanden kunnen stabiliseren voor vele andere elementen. Hoe groter het aantal fluoratomen, hoe reactiever de verbinding zal zijn (tenzij het een polymeer is). Evenzo zullen de effecten ervan met moleculaire matrices toenemen; In voor en tegenspoed.
[TOC]
Geschiedenis
Gebruik van fluoriet
In 1530 ontdekte de Duitse mineralogist Georgius Agricola dat fluorspar -mineraal kon worden gebruikt bij metaalzuivering. Fluorspar is een andere naam voor fluoriet, een fluormineraal dat bestond uit calciumfluoride (CAF2)).
Het fluorelement was toen nog niet ontdekt en het "fluoir" in het fluoriet kwam van het Latijnse woord "fluere" wat "stroom" betekent; Sindsdien was dit wat de fluorspar of fluoriet deed met metalen: het hielp hen om het monster te verlaten.
Bereiding van fluorhorinezuur
In 1764 beheerde Andreas Sigismud Margraff. Glazen terugkeer gesmolten door de werking van zuur, dus het glas werd vervangen door metalen.
Het wordt ook toegeschreven aan Carl Scheele in 1771, de bereiding van zuur door dezelfde methode gevolgd door Margraff. In 1809 stelde de Franse wetenschapper Andre-Marie Ampere voor dat fluor- of fluorhorinezuur een verbinding was gevormd door waterstof en een nieuw element vergelijkbaar met chloor.
Wetenschappers probeerden fluor te isoleren door het gebruik van fluorhorisch zuur gedurende een lange tijd; Maar het gevaar heeft in dit opzicht vooruitgang geboekt.
Humphry Davy, Joseph Louis Gay-Lussac en Jacques Thénard hadden sterke pijn bij het inademen van het waterstoffluoride (fluoridezuur zonder water en in een gasvormige vorm))). In vergelijkbare omstandigheden stierven wetenschappers Paulin Louyet en Jerome Nickles door vergiftiging.
Edmond Fréme, Franse onderzoeker, probeerde droog fluorhoridezuur te creëren om de toxiciteit van waterstoffluoride te voorkomen door verzuring van kaliumbifluoride (KHF2), Maar tijdens elektrolyse was er geen geleiding van de elektrische stroom.
Isolatie
In 1860 probeerde de Engelse chemicus George Gore het geprobeerd. Er was echter een explosie door gewelddadig recombinatie van waterstof met fluoride. Gore schreef de explosie toe aan een zuurstoflekkage.
In 1886 slaagde de Franse chemicus Henri Moisson erin om voor het eerst fluoride te isoleren. Eerder werd het werk van Moisson vier keer onderbroken vanwege ernstige vergiftiging met waterstoffluoride, terwijl hij probeerde het element te isolatie.
Moisson was een geweldige student en was gebaseerd op zijn experimenten om fluoride te isoleren. Moisson gebruikt bij elektrolyse een mengsel van kaliumfluoride en fluorhorinezuur. De resulterende oplossing leidde elektriciteit en fluorgas opgebouwd in de anode; dat wil zeggen in de positief geladen elektrode.
Moisson gebruikte een corrosie -resistente apparatuur, waarin de elektroden waren gemaakt van een platina- en iridiumlegering. Bij elektrolyse gebruikte het een platinacontainer en koelde de elektrolytische oplossing bij een temperatuur van -23 ºF (-31 ºC).
Uiteindelijk, op 26 juni 1886, slaagde Henri Moisson erin om fluoride te isoleren, een werk dat hem in staat stelde de Nobelprijs te winnen in 1906.
Interesse in fluoride
Voor een tijdje ging de interesse in onderzoek met fluoride verloren. De ontwikkeling van het Manhattan -project voor de productie van de atoombom.
Het Amerikaanse bedrijf DuPont ontwikkelde zich tussen 1930 en 1940 gefluoreerde producten zoals chlorofluorocarbonaten (Freon-12), gebruikt als koelmiddelen; en polythetafluorethyleen plastic, het beste bekend met de naam Teflon. Dit veroorzaakte een toename van de productie en consumptie van fluor.
In 1986, op een conferentie voor een eeuw van fluorisolatie, de Amerikaanse chemicus Karl of. Christe presenteerde een chemische methode voor het bereiden van fluoride door reactie tussen k2MNF6 en de SBF5.
Kan u van dienst zijn: polyvinylalcoholFysische en chemische eigenschappen
Verschijning
Fluor is een lichtgeel gas. In vloeibare toestand is het felgeel. Ondertussen kan de vaste stof ondoorzichtig zijn (alfa) of transparant (bèta).
Atoomnummer (z)
9.
Atoomgewicht
18.998 u.
Smeltpunt
-219.67 ºC.
Kookpunt
-188.11 ºC.
Dikte
Bij kamertemperatuur: 1.696 g/l.
Op het smeltpunt (vloeistof): 1,505 g/ml.
Verdampingswarmte
6.51 kJ/mol.
Molaire caloriecapaciteit
31 J/(mol · k).
Dampdruk
Bij een temperatuur van 58 K heeft een dampdruk van 986,92 atm.
Warmtegeleiding
0.0277 w/(m · k)
Magnetische volgorde
Diamagnetisch
Geur
Pittige en penetrerende karakteristieke geur, zelfs bij 20 ppb detecteerbaar.
Oxidatienummers
-1, wat overeenkomt met fluoride -anion, f-.
Ionisatieenergie
-Eerst: 1.681 kJ/mol
-Ten tweede: 3.374 kJ/mol
-Derde: 6.147 kJ/mol
Elektronegativiteit
3.98 Op de Pauling -schaal.
Het is het chemische element met de grootste van elektronegativiteiten; dat wil zeggen, het heeft een hoge affiniteit voor de elektronen van de atomen waarmee het is gekoppeld. Daarom genereren fluoratomen grote dipoolmomenten in specifieke gebieden van een molecuul.
Zijn elektronegativiteit heeft ook een ander effect: atomen die aan hem zijn gekoppeld, verliezen zoveel elektronische dichtheid dat ze een positieve belasting beginnen te verwerven; Dit is een positief oxidatienummer. Hoe meer fluoratomen in een verbinding, het centrale atoom zal een positiever oxidatienummer hebben.
Bijvoorbeeld in de van2 Zuurstof heeft een oxidatienummer van +2 (of2+F2-); In de UF6, Uranium heeft een oxidatienummer van +6 (u6+F6-); Hetzelfde geldt voor zwavel in de SF6 (S6+F6-); En ten slotte is de AGF2, waar zilver zelfs een oxidatienummer van +2 heeft, ongewoon in.
Daarom slagen de elementen erin om deel te nemen met hun meest positieve oxidatienummers wanneer ze verbindingen vormen met fluoride.
Oxidatiemiddel
Fluor is het krachtigste oxiderende element, dus geen enkele stof kan het oxideren; En om deze reden is hij niet vrij van aard.
Reactiviteit
Fluor kan combineren met alle andere elementen, behalve met helium, neon en argon. Het valt ook geen zoet staal of koper aan bij normale temperaturen. Reageer gewelddadig met organische materialen, zoals rubber, hout en stof.
Het fluoride kan reageren met het edelgas xenon om het sterke difluoruro -oxidant van xenon, xef te vormen2. Het reageert ook met waterstof om een halogenide, waterstoffluoride, HF te vormen. Op zijn beurt wordt waterstoffluoride opgelost in water om het beroemde fluorhorinezuur te produceren (eetglas).
De zuurgraad van hydracingzuren, geclassificeerd in toenemende volgorde is:
HF < HCl < HBr < HI
Tikstofzuur reageert met fluoride om fluornitraat te vormen, FNO3. Ondertussen reageert zoutzuur krachtig met fluoride om HF te vormen, van2 en CLF3.
Elektronische structuur en configuratie

Diatomeeënmolecuul
 Fluoridemolecuul vertegenwoordigd met ruimtevulmodel. Bron: Gabriel Bolívar.
Fluoridemolecuul vertegenwoordigd met ruimtevulmodel. Bron: Gabriel Bolívar. Het fluoratoom in zijn basale toestand heeft zeven elektronen van Valencia, die volgens de elektronische configuratie in de orbitalen 2s en 2p zijn:
[Hij] 2s2 2 p5
De Valencia Link Theory (TEV) stelt vast dat twee fluoratomen, f, covalent zijn gekoppeld om hun octet in Valencia elk te kunnen voltooien.
Dit gebeurt snel omdat het nauwelijks een elektron ontbreekt om isolectronisch tot nobel neongas te worden; En de atomen zijn erg klein, met een zeer sterke effectieve nucleaire belasting die gemakkelijk elektronen van de omgeving vereist.
Het molecuul f2 (Superieure afbeelding), heeft een eenvoudige covalente link, f-f. Ondanks de stabiliteit in vergelijking met vrije F -atomen, is het een extreem reactief molecuul; Homonuclear, Apolar en enthousiast voor elektronen. Dat is de reden waarom fluoride, zoals f2, Het is een zeer giftige en gevaarlijke soort.
Omdat de f2 Het is apolair, zijn interacties zijn afhankelijk van zijn moleculaire massa en de dispersiekrachten in Londen. Op een gegeven moment moet de elektronische wolk rond beide F -atomen een onmiddellijke dipool vervormen en ontstaan die een andere induceert in een aangrenzend molecuul; zodat ze langzaam en zwak zijn.
Vloeibaar en vast
Het molecuul f2 Het is erg klein en verspreidt zich in de ruimte met relatieve snelheid. In zijn gasfase vertoont het een lichtgele kleur (die kan worden verward met een limoengroen). Wanneer de temperatuur daalt tot -188 ºC, worden de dispersiekrachten effectiever en maken de moleculen f2 samenhang genoeg om een vloeistof te definiëren.
De vloeibare fluor (eerste afbeelding) ziet er nog meer geel uit dan zijn respectieve gas. Daarin zijn de moleculen f2 Ze zijn dichterbij en communiceren in grotere mate met het licht. Interessant is dat zodra het vervormde kubieke glas is gevormd van fluor tot -220 ºC, de kleur vervaagt en een transparante vaste stof vervaagt.
Kan u van dienst zijn: vertakte alkanesNu de M -moleculen2 Ze zijn zo dichtbij (maar zonder hun moleculaire rotaties stoppen), lijkt het erop dat hun elektronen enige stabiliteit verdienen en daarom is hun elektronische sprong te groot om het licht zelfs te communiceren met het glas.
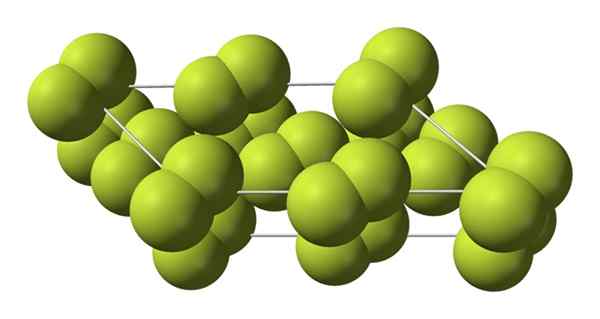
Kristallijne fasen
Dit kubieke kristal komt overeen met de β -fase (het is geen alotrope omdat het hetzelfde blijft f2)). Wanneer de temperatuur nog meer daalt, tot -228 ºC, lijdt de vaste fluor een faseovergang; Het kubieke glas wordt omgezet in een monoklinische, de α -fase:
 Kristallijne structuur van de alfasefase van fluor. Bron: Benjah-bmm27 [Public Domain].
Kristallijne structuur van de alfasefase van fluor. Bron: Benjah-bmm27 [Public Domain]. In tegenstelling tot β-F2, De α-F2 is ondoorzichtig en hard. Misschien is het omdat de M -moleculen2 Ze hebben niet langer zo'n vrijheid om te roteren in hun vaste posities in monokliene kristallen; waar ze in grotere mate met het licht op elkaar inwerken, maar zonder hun elektronen op te wekken (wat op oppervlakkig hun dekking zou verklaren).
De kristallijne structuur van α-F2 Het was moeilijk om te studeren via conventionele X -Ray diffractiemethoden. Dit komt omdat de overgang van fase β naar α zeer exotherme is; Dus het kristal werd praktisch uitgebuit, terwijl het weinig interactie heeft met straling.
Ze brachten ongeveer vijftig jaar door voor Duitse wetenschappers (Florian Kraus en medewerkers), de α-F-structuur volledig ontcijferen2 met grotere precisie dankzij neutron diffractietechnieken.
Waar is het en verkrijgt
Fluor bezet de 24e van de meest voorkomende elementen in het universum. Op aarde is echter in massa de 13vo Element, met een concentratie van 950 ppm in de aardkorst en een concentratie van 1,3 ppm in zeewater.
De bodem heeft een fluorconcentratie tussen 150 en 400 ppm, en op sommige bodem kan de concentratie 1 bereiken.000 ppm. In de atmosferische lucht is het aanwezig in een concentratie van 0,6 ppb; Maar het heeft zich geregistreerd in sommige steden tot 50 ppb.
Fluor wordt voornamelijk verkregen uit drie mineralen: fluoriet of fluorospar (koffie2), De fluoroapatita [ca5(PO4))3F] en de Creools (na3Alf6)).
Fluorietverwerking
Na het verzamelen van de rotsen met het fluorietmineraal, zijn deze onderhevig aan primaire en secundaire verpletterende. Met de secundaire verpletterende van het verkrijgen van zeer kleine rotsfragmenten.
Vervolgens worden rotsfragmenten naar een balfabriek gebracht voor stofreductie. Water en reagentia worden toegevoegd om een pasta te vormen, die in een flotatietank wordt geplaatst. Het wordt geïnjecteerd met druk om bubbels te vormen, en dus komt het fluoriet op het waterige oppervlak.
Silicaten en carbonaten zijn sediment terwijl fluoriet wordt verzameld en leidt tot drogende ovens.
Zodra het fluoriet is verkregen, wordt het gereageerd met zwavelzuur om waterstoffluoride te produceren:
Café2 + H2SW4 => 2 hf +case4
Waterstoffluoride -elektrolyse
Bij de productie van fluoride worden enkele wijzigingen gevolgd, met de methode die Moisson in 1886 gebruikt.
Een elektrolyse van een mengsel van gesmolten kaliumfluoride en fluohydrinezuur wordt gemaakt, met een molaire straal van 1: 2,0 tot 1: 2.2. De gesmolten zouttemperatuur is 70 - 130 ºC.
De kathode bestaat uit een monet of stalen legering, en de anode is van het herhalen van steenkool. Het productieproces van de fluor tijdens elektrolyse kan als volgt worden gepresteerd:
2HF => H2 + F2
Water wordt gebruikt om de elektrolysekamer af te koelen, maar de temperatuur moet zich boven het smeltpunt van de elektrolyt bevinden om stolling te voorkomen. Waterstof geproduceerd bij elektrolyse wordt verzameld in de kathode, terwijl fluoride in de anode.
Isotopen
De fluoride heeft 18 isotopen, zijnde de 19F De enige stabiele isotoop met 100% overvloed. Hij 18F heeft een halfwaardetijd van 109,77 minuten en is de radioactieve isotoop van fluor met de grootste halve levensduur. Hij 18F Het wordt gebruikt als een positronbron.
Biologisch papier
Er is geen metabole activiteit van fluor bij zoogdieren of bovenste planten bekend. Sommige zeeplanten en sponzen synthetiseren echter monofluroacetaat, een giftige verbinding, die als bescherming gebruiken om vernietiging te voorkomen.
Risico's
Overmatig fluorconsumptie is geassocieerd met botfluorose bij volwassenen en tandfluorose bij kinderen, evenals met veranderingen in nierfunctioneren. Om deze reden suggereerde de Verenigde Staten Public Health Service (PHS) dat fluorideconcentratie in drinkwater niet groter mag zijn dan 0,7 mg/l.
Ondertussen heeft de US EnviromeTal Protection Agency (EPA) vastgesteld dat de concentratie van fluoride in drinkwater niet groter mag zijn dan 4 mg/L, om skeletfluorose te voorkomen, waarbij fluoride zich ophoopt in de botten. Dit kan botverzwakking en breuken veroorzaken.
Fluor is gerelateerd aan schade aan de parathyroid -klier, met een afname van calcium in botstructuren en hoge calciumconcentraties in plasma.
Het kan u van dienst zijn: Living Matter: Concept, Kenmerken en voorbeeldenOnder de veranderingen die worden toegeschreven aan overtollige fluor zijn de volgende: Tandheelkundige fluorose, skeletfluorose en schade aan de paratyroid -klier.
Tandheelkundige fluorose
Tandheelkundige fluorose wordt gepresenteerd met kleine strepen of motorfietsen in het tandglazuur. Kinderen jonger dan 6 mogen geen mondwater gebruiken met fluoride.
Skeletale fluorose
Bij skeletfluorose kunnen pijn en schadeschade worden gediagnosticeerd, evenals in de gewrichten. Het bot kan de elasticiteit verharden en verliezen, wat het risico op fracturen verhoogt.
Toepassingen
Tandpasta
 Sommige anorganische zouten van fluoride worden gebruikt als een additief in de formulering van tandheelkundige pasta's, die hebben aangetoond dat ze helpen het tandheelkundige email te beschermen. Bron: Pxhere.
Sommige anorganische zouten van fluoride worden gebruikt als een additief in de formulering van tandheelkundige pasta's, die hebben aangetoond dat ze helpen het tandheelkundige email te beschermen. Bron: Pxhere. We beginnen met het gedeelte van het gebruik voor fluoride met dat bekend: om te dienen als een onderdeel van veel tandheelkundige pasta's. Dit is niet het enige gebruik waarbij het contrast tussen zijn molecuul F te zien is2, extreem giftig en gevaarlijk, en anion f-, die afhankelijk van zijn omgeving gunstig kan zijn (hoewel soms niet).
Wanneer we voedsel eten, vooral snoep, degraderen bacteriën hen af door de zuurgraad van ons speeksel te vergroten. Dan is er een punt waarop de pH voldoende is om het tandheelkundige email af te breken en te demineraliseren; Hydroxiapatite komt "naar beneden".
In dit proces echter de ionen f- interactie met CA2+ om een fluorapatietmatrix te vormen; Stabieler en duurzamer dan hydroxyapatiet. Of tenminste, dit is het voorgestelde mechanisme om de werking van het fluoride -anion op de tanden te verklaren. Het is waarschijnlijk dat het complexer is en dat er een hydroxyapatiet-fluorapatiet is afhankelijk van de pH.
Deze anionen f- Ze zijn verkrijgbaar in tandpapa's in zouten; zoals: NAF, SNF2 (Het beroemde stine -fluoride) en Napof. De concentratie van F- Het moet laag zijn (minder dan 0,2%), omdat het anders negatieve effecten op het lichaam veroorzaakt.
Waterfluorisatie
Zeer vergelijkbaar met hoe met tandpasta's, fluoridezouten zijn toegevoegd aan drinkwaterbronnen om het uiterlijk van cariës te bestrijden bij degenen die het drinken. De concentratie moet nog veel lager zijn (0,7 ppm). Deze praktijk is echter meestal wantrouwend en controverse, mogelijk zijn carcinogene effecten toegeschreven.
Oxidatiemiddel
Het gas f2 Het gedraagt zich als een zeer sterk oxidatiemiddel. Hierdoor regelen veel verbindingen meer dan wanneer ze worden blootgesteld aan zuurstof en een warmtebron. Daarom is het gebruikt in raketbrandstofmengsels, waarin ze zelfs ozon kunnen vervangen.
Polymeren
In veel toepassingen zijn fluoridebijdragen niet te wijten aan F2 of f-, maar direct op zijn elektronegatieve atomen die deel uitmaken van een organische verbinding. Daarom, in de essentie van een C-F-link.
Afhankelijk van de structuur zijn polymeren of vezels met C-F-bindingen meestal hydrofoob, zodat ze niet nat worden of de aanval van fluorhorinezuur weerstaan; Of nog beter, het kunnen uitstekende elektrische isolatoren zijn en nuttige materialen waarmee objecten zoals buizen en gewrichten worden vervaardigd. Teflon en Navion zijn voorbeelden van deze gefluoreerde polymeren.
Apothekers
De reactiviteit van fluoride wordt het gebruik ervan genoemd voor de synthese van meerdere fluorine, organische of anorganische verbindingen. In organische, met name die met farmacologische effecten, vervangen een van hun heteroátomos door atomen F verhoogt (positief of negatief) de werking op hun biologische doelstelling.
Dat is de reden waarom in de farmaceutische industrie de aanpassing van sommige medicijnen altijd op tafel ligt door fluoratomen toe te voegen.
Zeer vergelijkbaar gebeurt met herbiciden en fungiciden. De fluor erin kan hun werking en effectiviteit op insecten en schimmels vergroten.
Glazen gravure
Fluorhorinezuur, vanwege de agressiviteit met glas en keramiek, is gebruikt om dunne en delicate stukken van deze materialen vast te leggen; Meestal bedoeld voor de productie van computers microcomponenten of voor elektrische bollen.
Uraniumverrijking
Een van de meest relevante toepassingen van elementaire fluoride is om uranium te verrijken als 235OF. Om dit te doen, lossen uraniummineralen op in fluorhorinezuur, waardoor UF wordt geproduceerd4. Dit anorganische fluoride reageert vervolgens met de F2, Om te transformeren in UF6 ((235OPLUCHTING6 En 238OPLUCHTING6)).
Vervolgens, en door een gascentrifugatie, de 235OPLUCHTING6 Het scheidt van 238OPLUCHTING6 en vervolgens geoxideerd en opgeslagen als nucleaire brandstof.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Krämer Katrina. (2019). De structuur van Frozen Fluor heeft na 50 jaar weergegeven. De Royal Society of Chemistry. Hersteld van: chemieworld.com
- Wikipedia. (2019). Fluor. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2019). Fluor. PubChem -database. CID = 24524. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Dr. Doug Stewart. (2019). Feiten van fluorelementen. Chemicool. Hersteld van: chemicool.com
- Batul Nafisa Baxamusa. (21 februari 2018). Het verrassend veel voorkomende gebruik van de zeer reactieve fluor. Hersteld van: sciencestruck.com
- Paola Opazo Sáez. (4 februari 2019). Fluoride in tandpasta: is het goed of slecht voor de gezondheid? Hersteld van: nacionfarma.com
- Karl Christe & Stefan Schneider. (8 mei 2019). Fluorine: chemisch element. Encyclopædia Britannica. Hersteld van: Britannica.com
- Lentech B.V. (2019). Tabel van de periode: zuurstof. Hersteld van: Lentech.com
- Gagnon Steve. (S.F.)). Het elementfluor. Jefferson Lab. Hersteld van: onderwijs.Jlab.borg
- Het medische en redactionele inhoudsteam van de American Cancer Society. (28 juli 2015). Waterfluoridatie en het risico op kanker. Hersteld van: kanker.borg
- « Exacte wetenschapskenmerken, wat studeer je, voorbeelden
- Geen metalen geschiedenis, eigenschappen, groepen, gebruik »

